解答:
解:X、Y、Z、W四种元素原子序数依次增大且均小于36. Z基态原子最外层电子数是其内层电子总数的3倍,只能有2个电子层,最外层电子数为6,则Z为O元素;Y原子序数小于O元素,其基态原子是同周期元素中未成对电子数最多的原子,处于ⅤA族,故Y为N元素;X分别与N、O元素组合均可形成10电子微粒,则X为H元素;W基态原子有10个价电子,为过渡元素,外围电子排布式为3d
84s
2,故W为Ni,
(1)若 NH
3与H
2O﹑NH
2-与OH
-﹑N
3-与O
2-性质相似,则Mg(NH
2)
2与氢氧化镁性质相似,一定条件下分解生成Mg
3N
2、NH
3,化学反应方程式为:3 Mg(NH
2)
2═Mg
3N
2+4NH
3↑,
故答案为:3 Mg(NH
2)
2═Mg
3N
2+4NH
3↑;
(2)已知0℃时H
2O的密度为a g/cm
3,其晶胞中H
2O分子的空间排列方式与金刚石晶胞类似,相似的原因是:水中的O和金刚石中的C都是sp
3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键;
晶胞中水分子位于顶点、面心上,晶胞内部还有4个水分子,故晶胞中水分子数目=4+8×
+6×
=8,则晶胞质量=
g,晶胞棱长=
=
cm,内部1个水分子与1个顶点水分子以及该顶点所在3个面的面心中水分子构成正四面体,则正四面体的棱长=
×
cm×
=
×
cm,令正四面体体心水分子到顶点距离为y,即水分子分子之间的距离y,到底面的距离为b,正四面体可以分成相同的4个四面体(由体心水分子与3个顶点水分子构成),则
πS(y+b)=4×
×πSb,故y=3b,假设棱长
×
为n,底面中心到顶点距离=
n cm×
=
n cm,故(
n)
2+(4b)
2=n
2,解得b=
n,故y=3b=3×
×
×
cm=
×
cm;
冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”=
×(51kJ/mol-11kJ/mol)=20kJ/mol,
故答案为:水中的O和金刚石中的C都是sp
3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键;
×
;20;
(3)①Ni是28号元素,根据原子核外电子排布规律可知,Ni
2+的基态核外电子排布式为1s
22s
22p
63s
23p
63d
8,每个电子运动状态都不相同,核外电子有26种运动状态
故答案为:1s
22s
22p
63s
23p
63d
8;26;
②尿素分子的结构简式为

,所以尿素分子中碳原子的杂化方式为sp
2杂化,每个分子中含有7个σ键,所以1mol尿素中含有7molσ键,含有的σ键数为7×6.02×10
23,
故答案为:sp
2;7×6.02×10
23;
③NO
3-中N原子孤电子对=
=0、价层电子对数=0+3=3,其空间构型平面正三角形,
故答案为:平面正三角形;
④因为氧化镍样品中Ni
3+与Ni
2+的离子数之比为6:91,所以镍元素的平均价为
=
根据化合物化合价代数各为零,得
x=2,则x=0.97,
故答案为:0.97.

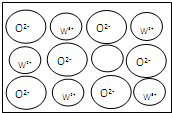
 ,所以尿素分子中碳原子的杂化方式为sp2杂化,每个分子中含有7个σ键,所以1mol尿素中含有7molσ键,含有的σ键数为7×6.02×1023,
,所以尿素分子中碳原子的杂化方式为sp2杂化,每个分子中含有7个σ键,所以1mol尿素中含有7molσ键,含有的σ键数为7×6.02×1023,

 发散思维新课堂系列答案
发散思维新课堂系列答案
 在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀质量与加入NaOH溶液质量关系如图所示,试计算:
在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀质量与加入NaOH溶液质量关系如图所示,试计算: