
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-1059.3 kJ/mol | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g);△H=-1076.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-1076.7 kJ/mol |
分析 已知①N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol;②N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534.0kJ/mol;利用盖斯定律将②×2-①可得2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g),并以此计算反应热.
解答 解:已知①N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol,
②N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534.0kJ/mol,
利用盖斯定律将②×2-①可得2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g),△H=(-534.0kJ/mol)×2-(+8.7kJ/mol)=-1076.7 kJ/mol,或N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1076.7 kJ/mol,
故选D.
点评 本题考查反应热的计算、盖斯定律的应用,题目难度中等,明确盖斯定律的内容及其应用方法为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
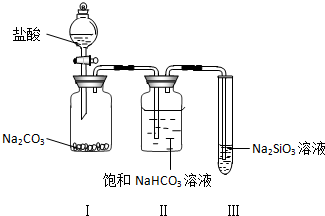
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L的氯化铁溶液中,若C1-的数目为3 NA,则Fe3+的数目为NA | |
| B. | 1 molN2和3 molH2在一定条件下充分反应,转移电子数目为6NA | |
| C. | 常温下,1L0.1mol/L的Na2S溶液中阴离子数目大于0.1 NA | |
| D. | 0.1 mol Cl2通入水中,转移电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 键能越大说明化学键越牢固,所构成的物质越稳定 | |
| B. | 高聚氮晶体属于原子晶体 | |
| C. | 该晶体中氮原子数与氮氮键数比为1:3 | |
| D. | 高聚氮可以用作炸药 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
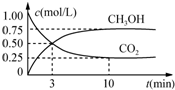 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3 min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向上述容器中充入0.5 mol CO2、1.5 mol H2,平衡时CO2的转化率小于75% | |
| D. | 12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3-、ClO- | |
| B. | 0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl-、I- | |
| C. | 0.1mol/L的NaAlO2溶液中:K+、H+、NO3-、SO42- | |
| D. | 无色透明的水溶液中:Mg2+、H+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
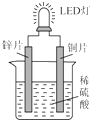 如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )
如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )| A. | 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生 | |
| B. | 如果将锌片换成铁片,电路中的电流方向将改变 | |
| C. | 其能量转化的形式主要是“化学能→电能→光能” | |
| D. | 如果将稀硫酸换成柠檬汁,LED灯将不会发光 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24LSO2所含有的分子数小于0.1NA | |
| B. | 1L 1 mol•L-1 FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA | |
| C. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA | |
| D. | 28.6gNa2CO3•10H2O溶于水配成1L溶液,该溶液中阴离子数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com