
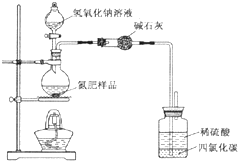
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液体积/mL | 40.00mL | ||
样品质量/g | 7.750 | 15.50 | 23.25 |
氨气质量/g | 1.870 | 1.870 | 1.700 |
分析 (1)①碱石灰用于干燥氨气;
②氨气极易溶于水,容易发生倒吸现象;
③反应生成的氨气不能够被稀硫酸完全吸收;
(2)①根据实验数据,判断出第一组实验中氢氧化钠过量,所有的铵离子都生成了氨气,根据氮原子守恒列式计算出样品中氮元素的质量分数;
②根据第一组数据计算出硫酸铵和硫酸氢铵的含量,再根据第二组中所有的氢氧化钠都参与了反应,即氢氧化钠不足,计算出氢氧化钠的浓度;
解答 解:(1)①生成的氨气中含有水分,用碱石灰吸收氨气中的水分,
故答案为:吸收氨气中的水蒸气;
②氨气极易溶于水,容易发生倒吸,所以广口瓶内四氯化碳用于防止倒吸,
故答案为:防止倒吸;
③用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外泄,由于装置内的氨气不能完全被稀硫酸吸收,测得的样品含氮量仍将偏低,
故答案为:残留在反应装置中的氨气未被稀硫酸吸收;
(2)①设氮肥硫酸铵的质量分数为X,则硫酸氢铵的质量分数为(1-X),
从实验方案的数据看出,第一个实验和第二个实验中生成的氨气质量相同,说明第一个实验中氢氧化钠是过量的,所有铵离子都生产了氨气,根据氮元素守恒,$\frac{7.75×X}{132}$×17+$\frac{7.75×(1-X)}{115}$=1.87
解得:X=0.85,
即氮肥中硫酸铵的质量分数为85%,硫酸氢铵的质量分数为15%,
根据氮原子守恒:氮原子的物质的量就等于氨气的物质的量,
所以样品中氮元素的质量分数为:$\frac{\frac{1.87}{17}×14}{7.75}$×100%=19.87%,
故答案为:19.87;
②假如第二个实验方案中氢氧化钠是过量的,则生成氨气质量为:$\frac{15.50×0.85}{132}$+$\frac{15.50×0.15}{115}$≈3.74g>1.87g,
这说明第二个实验方案中,氢氧化钠的物质的量不足,氢氧化钠反应完硫酸氢铵中的氢离子后全部生成硫酸铵,剩余的氢氧根离子不足以将全部铵根离子反应溢出,而是只反应了一部分硫酸铵,放出了1.87g氨气;
根据反应方程式:2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O,
加入的氢氧化钠的物质的量为:n(NH4HSO4)+n(NH3)=$\frac{15.5×0.15}{115}$mol+$\frac{1.87}{17}$mol≈0.13mol,
氢氧化钠溶液的浓度为:$\frac{0.13mol}{0.04L}$=3.25mol/L,
故答案为:3.25.
点评 本题考查了测定氮肥硫酸铵中氮元素的含量,题目计算量比较大,需要合理分析、应用题中实验数据,得出正确结论,本题充分考查了所学的分析、理解和综合计算能力,本题难度稍大.


科目:高中化学 来源: 题型:选择题
| A. | NaOH 溶液保存在带玻璃塞的试剂瓶中 | |
| B. | 配制FeCl2 溶液时,通常向溶液中加入少量Fe 粉 | |
| C. | Cl2 和SO2 都有漂白作用,将Cl2 和SO2 等体积混合后可使品红溶液更快褪色 | |
| D. | 配制物质的量浓度的溶液,定容时仰视刻度线会使所配制的溶液浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:X<Z | |
| B. | 原子半径:W>Y>Z>X | |
| C. | 最高价氧化物对应水化物的碱性:Y>W | |
| D. | Y、Z的氧化物都有酸性和碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.
合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.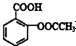 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为: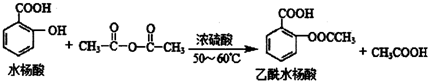
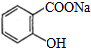 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验步骤和操作 | 实验现象 |
| 实验一 | (Ⅰ)取氯化亚铁固体[已部分变质,含有少量难溶于水的杂质Fe(OH)2Cl],向其中加入过量稀盐酸. (Ⅱ)再加入稍过量的铁粉,振荡. | 固体完全溶解,溶液呈黄绿色 Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O |
| 实验二 | (Ⅰ)取实验一得到的溶液,加入KSCN溶液. (Ⅱ)再加入少量H2O2溶液. | 颜色无明显变化 溶液变红,有少量气泡 |
| 实验三 | (Ⅰ)取10mL 0.1mol/L KI溶液,滴加6滴0.1mol/L FeCl3溶液. (Ⅱ)取少量上述黄色溶液,滴加KSCN溶液. (Ⅲ)另取上述的黄色溶液,加入淀粉溶液. | 溶液呈黄色 溶液变红 溶液变蓝 |
| 实验四 | (Ⅰ)向实验三步骤I中所得的黄色溶液中加入2mL CCl4,充分振荡后,分离得到水层;重复操作三次. (Ⅱ)向步骤I中所得水层中加入KSCN溶液. | 颜色无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ② | B. | ②④ | C. | ①③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液【FeCl3】:加足量铁粉 | B. | NaCl溶液【Na2SO4】:用Ba(OH)2溶液 | ||
| C. | Na2CO3固体【NaHCO3】:加热 | D. | 铁粉【铝粉】:用NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液中离子浓度间的关系有:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常温下,pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com