
| A. | 负极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| B. | 正极反应式为O2+2H2O+4e-═4OH- | |
| C. | 随着不断放电,电解质溶液碱性不变 | |
| D. | 甲烷燃料电池也可以用稀硫酸做电解质溶液 |
分析 A、燃料在负极上失电子发生氧化反应,据电解质环境书写电极反应式;
B、正极上氧气发生得电子的还原反应,根据电解质环境进行电极反应式的书写;
C、根据总反应方程式CH4+2O2+2KOH=K2CO3+3H2O来判断;
D、物质燃烧时产生的热能是不可能全部转化为功.
解答 解:A、燃料在负极上失电子发生氧化反应,甲烷燃烧能生成二氧化碳和水,二氧化碳和氢氧化钾反应生成碳酸钾,所以电极反应式为:CH4+10OH--8e-═CO32-+7H2O,故A正确;
B、氧气在正极上得电子,因为电解质溶液是氢氧化钾溶液,所以氧气得电子和水反应生成氢氧根离子,所以电极反应式为:O2+2H2O+4e-═4OH-,故B正确;
C、该电池的电池反应式为:CH4+2O2+2KOH=K2CO3+3H2O,溶液由碱溶液变成盐溶液,所以碱性减弱,故C错误;
D、根据能量转化的规律,燃烧时产生的热能是不可能全部转化为功的,能量利用率不高,而电能转化为功的效率要大得多,故D正确;
故选C.
点评 本题考查了燃料电池,电极反应式的书写要注意结合电解质溶液判断电极上的生成物,原料相同,电解质溶液不同,电极反应式就不同.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
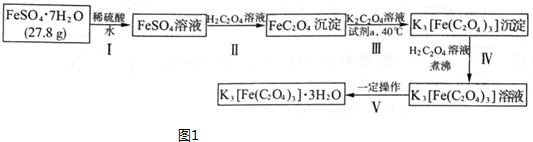
科目:高中化学 来源: 题型:解答题
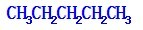 ;
; ;
;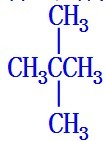 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
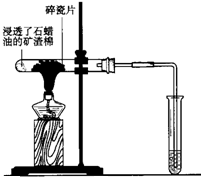 如图所示,将浸透了石蜡油的(17个碳原子以上的液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体.利用该气体进行实验:
如图所示,将浸透了石蜡油的(17个碳原子以上的液态烷烃混合物)的石棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面发生反应,生成一定量的气体.利用该气体进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
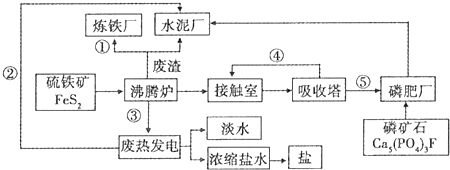
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素的单质在常温下均为金属晶体 | |
| C. | 金属元素在不同的化合物中的化合价均不同 | |
| D. | 金属元素在一般化合物中只显正价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com