
分析 ①该离子方程式表示锌与非氧化性强酸反应的一类反应,酸可以为盐酸或稀硫酸;
②表示可溶性碳酸氢盐与强酸反应生成二氧化碳气体和水的反应,据此写出满足条件的化学方程式.
解答 解:①Zn+2H+═Zn2++H2↑表示金属Zn与非氧化性强酸反应生成可溶性锌盐和水的反应,如:Zn+2HCl=ZnCl2+H2↑或Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+2HCl=ZnCl2+H2↑(或Zn+H2SO4=ZnSO4+H2↑);
②离子方程式HCO3-+H+═CO2↑+H2O表示可溶性碳酸氢盐与强酸反应生成可溶性盐、二氧化碳气体和水的反应,如:NaHCO3+HCl=NaCl+CO2↑+H2O,
故答案为:NaHCO3+HCl=NaCl+CO2↑+H2O.
点评 本题考查离子方程式的书写及表示的意义,题目难度中等,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析,试题培养了学生的灵活运用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 直径介于1nm-100nm之间的微粒称为胶体 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
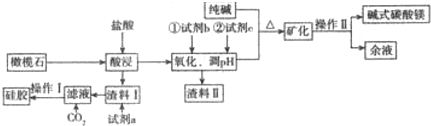
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有10NA个电子转移时,放出1300kJ的能量 | |
| B. | 有1NA个水分子生成且为液体时,吸收1300kJ的能量 | |
| C. | 有2NA个碳氧共用电子对生成时,放出1300kJ的能量 | |
| D. | 有8NA个碳氧共用电子对生成时,吸收1300kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 温度 | 初始pH | 0.1 mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g C-13含有的原子数为NA个 | |
| B. | 46g NO2和46g N2O4含有的原子数均为3NA | |
| C. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| D. | 标准状况下,2.24L乙醇所含分子数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com