
【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是________
4CO2(g)+N2(g)。恒温恒容条件下,能够说明该反应已达到平衡状态的是________![]() 填字母代号
填字母代号![]() 。
。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2V逆(NO2)=V正(N2)
D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H时,反应进行到不同时间测得各物质的量浓度如下表所示:
N2(g)+CO2(g)△H时,反应进行到不同时间测得各物质的量浓度如下表所示:
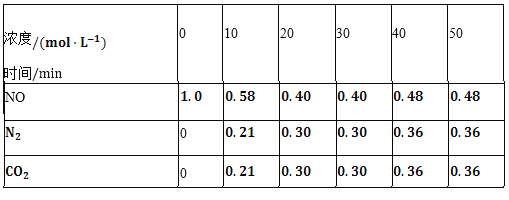
①根据表中数据分析T1℃时,该反应在0~20min的平均反应速率v(CO2)________;计算该反应的平衡常数![]() ________。
________。
②根据上表数据判断,由30min到40min时改变的条件可能是________![]() 任写一种
任写一种![]() 。
。
③若30min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,此时NO的转化率________![]() 填“升高”或“降低”
填“升高”或“降低”![]() ,△H________
,△H________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。(3)以
。(3)以![]() 与
与![]() 为原料可合成化肥尿素化学式为
为原料可合成化肥尿素化学式为![]() 。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,写出CO2与NH3合成尿素和液态水的热化学方程式_____
。已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol,③H2O(l)=H2O(g)△H=+44.0kJ/mol,写出CO2与NH3合成尿素和液态水的热化学方程式_____
【答案】A、B 0.015molL-1min-1 0.56(或![]() ) 通入一定量NO或适当缩小容器体积或者充入一定量1:1的氮气和二氧化碳 降低
) 通入一定量NO或适当缩小容器体积或者充入一定量1:1的氮气和二氧化碳 降低 ![]()
![]() ΔH=-87kJmol-1
ΔH=-87kJmol-1
【解析】
(1)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量浓度等不再发生变化;
(2)①由化学反应速率和化学平衡常数公式计算可得;
②由表数据可知40min时,反应的平衡常数与30min中相同,由此分析影响化学平衡移动因素;
③由题给数据可知NO的转化率为![]() ×100%=60%,由30min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5:3:3计算NO的转化率,判断平衡移动方向;
×100%=60%,由30min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5:3:3计算NO的转化率,判断平衡移动方向;
(3)由盖斯定律计算可得。
(1)A. 恒温恒容条件下,容器内混合气体颜色不再变化说明二氧化氮的浓度不变,说明正逆反应速率相等,反应达到平衡状态,故正确;
B. 该反应是反应前后气体体积有变化的反应,容器中的压强不再发生变化,说明正逆反应速率相等,反应达到平衡状态,故正确;
C.2V逆(NO2)=V正(N2)说明正逆反应速率不相等,反应没有达到平衡状态,故错误;
D.该反应是反应前后都是气体的反应,由质量守恒定律可知,反应前后气体质量不变,容器恒温恒容条件下,容器的体积不变,容器内混合气体密度始终保持不变,则容器内混合气体密度保持不变不能说明正逆反应速率相等,不能判断反应是否达到平衡状态,故错误;
AB正确,故答案为:AB;
(2)①由表中数据可知0~20min內二氧化碳的浓度变化量为0.30mol/L,则v(CO2)= ![]() =0.015molL-1min-1;20min分钟时反应达到平衡,平衡时各物质的浓度分别为c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,则反应的平衡常数K=
=0.015molL-1min-1;20min分钟时反应达到平衡,平衡时各物质的浓度分别为c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,则反应的平衡常数K=![]() =
=![]() =
=![]() ≈0.56,故答案为:0.015molL-1min-1;0.56(或
≈0.56,故答案为:0.015molL-1min-1;0.56(或![]() );
);
②由表数据可知40min时,反应的平衡常数K=![]() =
=![]() ,平衡常数不变说明改变的条件一定不是温度,依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是通入一定量NO或适当缩小容器体积或者充入一定量1:1的氮气和二氧化碳,故答案为:通入一定量NO或适当缩小容器体积或者充入一定量1:1的氮气和二氧化碳;
,平衡常数不变说明改变的条件一定不是温度,依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是通入一定量NO或适当缩小容器体积或者充入一定量1:1的氮气和二氧化碳,故答案为:通入一定量NO或适当缩小容器体积或者充入一定量1:1的氮气和二氧化碳;
③由题给数据可知NO的转化率为![]() ×100%=60%,若30min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,设此时NO的转化率为2x,由题意建立如下三段式:
×100%=60%,若30min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,设此时NO的转化率为2x,由题意建立如下三段式:
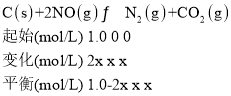
由容器中NO、N2、CO2的浓度之比为5:3:3可得(1.0—2x):x=5:3,解得2x=![]() <60%;温度升高NO的转化率减小,平衡向逆反应方向移动,该反应为放热反应,ΔH<0,故答案为:降低;<;
<60%;温度升高NO的转化率减小,平衡向逆反应方向移动,该反应为放热反应,ΔH<0,故答案为:降低;<;
(3)由盖斯定律可知,①+②—③可得CO2与NH3合成尿素和液态水的热化学方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=△H1+△H2—△H3=(-159.5kJ/mol)+(+116.5kJ/mol)—(+44.0kJ/mol)=-87.0kJ/mol,则热化学方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0kJ/mol,故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0kJ/mol。


科目:高中化学 来源: 题型:
【题目】中学化学涉及多种常数。 下列说法正确的是
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.对于反应:3A(g)+2B(g) 4C(s)+2D(g)的化学平衡常数表达式为 K= ![]()
C.KW 不是水的电离平衡常数
D.难溶电解质 AB2 饱和溶液中,c(A2+)=x mol·L-1,c(B-)=y mol·L-1,则 Ksp 值为 4xy2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气重整和水气变换是传统的制氢方法,反应如下 :
①CH4(g)+H2O(g)CO(g)+3H2 (g) △H1= 206kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2= - 4 1 kJmol-1
近期报道,用二氧化碳作为氧化剂和甲烷重整制氢的新反应路线如下,可生成适宜 H2/ CO 的合成气。
③CH4 (g)+CO2 (g)2CO(g)+2H2(g) △H3
(1)下列措施最有利于提高反应③CH4的平衡转化率条件是______________。
A. 升高温度,同时对原料气进行加压 B. 降低温度,同时对原料气进行加压
C. 升高温度,同时用氩气稀释原料气 D. 降低温度,同时用氩气稀释原料气
(2)重整反应器中以上三个反应都在发生,不同反应条件下达到平衡时的进程如下:
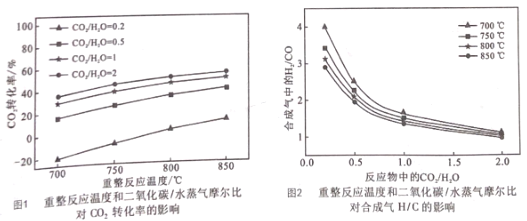
I.根据图1,在_________ ( 填写反应条件)时CO2的转化率为负值,主要原因:一是 CO2稳定性较高,低浓度时难以和甲烷反应;二是 ___________。
II.根据图,2随着反应温度和反应物中![]() 的提高,体系中反应____填①、②、③)逐渐占据主导。若 850℃、
的提高,体系中反应____填①、②、③)逐渐占据主导。若 850℃、![]() 为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=__。
为0.5时重整反应器中达到平衡时,体系中CO2和水蒸气浓度相等,求此条件下反应②的平衡常数K=__。
(3)固体氧化物电解池(传导O2-)将CO2 和H2O 转化为n(H2):n(CO)=1的合成气并联产高纯度O2,写出电解池阴极反应式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案:

(1)小明同学用图中的发生、收集装置。甲、乙两试管各有两根导管,连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体。则稀硫酸应置于____中(填“甲”或“乙”);G管可以用化学实验室里的一种常用仪器代替,你认为这种仪器的名称是____。仪器甲、乙接口的连接方式如下:A连接___,C连接F;(填写接口的编号)
(2)小李同学用沉淀法测定Na2SO3的质量分数。
操作流程:

①操作Ⅱ的名称是_______。
②操作Ⅰ之前,为判断所加BaCl2溶液是否过量, 设计如下方案,其中最合理的是___。
A.取少量上层清液,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
B.待浊液澄清后,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量。
C.待浊液澄清后,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
③根据以上数据得出Na2SO3的质量分数为_____。
④小丽同学经认真分析,上述实验操作均正确,但发现实验结果与预期相差较大,请你推测可能的原因是______,验证方法__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是药物合成的种中间体,可通过以下方法合成:

(1)B中官能团名称为__。
(2)G→H的反应类型为__。
(3)已知C的一种同分异构体为: ,下列说法正确的是__。
,下列说法正确的是__。
a.能发生酯化反应
b.能发生银镜反应
c.1mol该物质完全水解能消耗3molNaOH
d.该分子的核磁共振氢谱中峰面积之比为1:2:6:2
e.其在酸性条件下的水解产物之一能与FeCl3溶液发生显色反应
(4) 中手性碳原子个数为__。
中手性碳原子个数为__。
(5)E的分子是为C14H17O3N,E经还原得到F,写出E→F的反应方程式:__。
(6)已知:①
②苯胺(![]() 易被氧化
易被氧化
请以甲苯和(CH3CO)2O为原料制备 ,写出制备的合成路线流程图(无机试剂任选)。__。
,写出制备的合成路线流程图(无机试剂任选)。__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
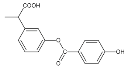
①分子式为C16H14O5 ②能使酸性高锰酸钾溶液褪色 ③能发生加成反应,但不能发生取代反应 ④苯环上的一溴代物有6种 ⑤1mol 该有机物与NaOH反应时最多消耗4mol NaOH ⑥1mol该有机物在一定条件下和H2反应,共消耗6molH2
A.①②③⑥B.①②③⑤C.①③④⑤⑥D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明许多疾病,包括基因突变(癌变、动脉硬化等)和生物机体中毒等,可能是一氧化氮的释放或调节不正常引起的。用间接电化学法可对NO进行无害化处理,其原理如图所示(质子膜允许H+和H2O通过),下列相关判断不正确的是 ( )
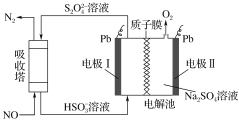
A.电极Ⅰ接电源负极,电极反应式为2HSO3-+2H++2e-==S2O42-+2H2O
B.质子从电极Ⅱ通过质子膜向电极Ⅰ作定向移动
C.吸收塔中的反应为2NO+2S2O42-+2H2O==N2+4HSO3-
D.每处理2 mol NO,电解池质量减少32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水中存在电离平衡:H2OH++OH- △H>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡正向移动,c(H+)增大
D.将水加热,KW增大,pH减小,酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室制备亚硝酰硫酸的方法如下:将SO2通入盛有浓硫酸和浓硝酸的混合液中,维持体系温度略低于20℃,搅拌,使其充分反应。反应过程中,亚硝酰硫酸的物质的量和硝酸的物质的量随时间的变化如图所示。
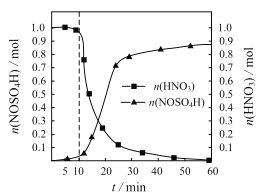
(1)①实验室制备NOSO4H的化学反应方程式为___。
②反应进行到10min后,反应速度明显加快,其可能的原因是___。
③反应过程中,硝酸减少的物质的量大于NOSO4H生成的物质的量的可能原因是___
(2)为了测定亚硝酰硫酸的纯度,进行如下实验:。
准确称取1.200g产品放入锥形瓶中,加入50.00mL0.1000mol·L-1的KMnO4标准溶液和足量稀H2SO4,摇匀,使其充分反应。再将反应后溶液加热至60~70℃(使生成的HNO3挥发逸出),冷却至室温,用0.2500mol·L-1Na2C2O4标准溶液滴定至终点,消耗Na2C2O4溶液的体积为16.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4;KMnO4在酸性条件下被还原为Mn2+。
根据以上实验数据计算亚硝酰硫酸的纯度。(写出计算过程)___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com