
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.硅晶体中,有NA个Si就有2NA个Si—Si键
B.同温同压下,相同体积的氟气和氩气所含的原子数相等
C.1 mol CnH2n中含有的共用电子对数为(3n+1)NA
D.在含2 mol H2SO4的浓硫酸中加入足量的Zn粉,充分反应后转移电子数为2NA
解析 1个Si原子和4个Si原子形成4个共价键,其中1个共价键由2个Si原子形成,故平均每个Si原子形成2个Si—Si键,A项正确;F2为双原子分子,Ar为单原子分子,故等物质的量的F2和Ar所含原子数不相等,B项错误;当n=2时,C2H4是乙烯,1 mol C2H4中含有6 mol共用电子对,不是7 mol,1 mol CnH2n含有的共用电子对数为3nNA,C项错误;随着反应进行,浓H2SO4变成稀H2SO4,锌也能与稀硫酸反应,D中的2 mol H2SO4能反应完,先发生Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O反应时,2 mol H2SO4转移2 mol电子,后发生Zn+H2SO4(稀)===ZnSO4+H2↑反应时,1 mol H2SO4转移2 mol电子,反应中转移电子数应为2NA~4NA之间。
答案 A


科目:高中化学 来源: 题型:
某混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH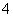 、Ba2+、Cl-、CO
、Ba2+、Cl-、CO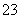 、SO
、SO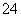 。现取两份200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36 g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54 g,经足量盐酸洗涤干燥后,沉淀质量为4.66 g。根据上述实验事实,以下推测正确的是(双选)( )
。现取两份200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36 g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54 g,经足量盐酸洗涤干燥后,沉淀质量为4.66 g。根据上述实验事实,以下推测正确的是(双选)( )
A.一定不存在Ba2+,可能存在NH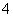
B.不可能存在Ba2+,可能存在Cl-
C.Na+一定存在,且c(Na+)≥0.2 mol·L-1
D.Na+、Cl-可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验、现象所对应的离子方程式不正确的是(双选)( )
| 选项 | 实验 | 现象 | 离子方程式 |
| A | 将稀硫酸滴加到KI-淀粉溶液中 | 在空气中放置一段时间后溶液呈蓝色 | 4H++4I-+O2===2I2+2H2O |
| B | 向FeBr2溶液中通入少量Cl2 | 溶液由浅绿色变成橙红色 | 2Br-+Cl2===Br2+2Cl- |
| C | 向酸性KMnO4溶液中加入适量NaNO2溶液 | 溶液紫色褪去 | 2MnO |
| D | 将Na2S加入到滴有酚酞的KCl溶液中 | 溶液由无色变为红色 | S2-+2H2O===H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
A.标准状况下,22.4 L CCl4中含有的CCl4分子数为NA
B.1.0 L 0.1 mol·L-1的Na2S溶液中含有的S2-的数目为0.1NA
C.在密闭容器中充入1.5 mol H2和0.5 mol N2,充分反应后可得到NH3的分子数为NA
D.1 mol Fe与过量的稀HNO3反应,转移3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
在CO、CO2、SO2、NO、NO2、SiO2等氧化物中:
①其中属于酸性氧化物的是________,能形成酸雨的是__________________;
②能与水发生氧化还原反应的是______________,反应的化学方程式为
________________________________________________________________________;
③能使品红溶液褪色的是__________;
④光导纤维的主要成分是________,它与氢氟酸、烧碱反应的化学方程式分别为
______________,____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
软锰矿(主要成分为MnO2)作脱硫剂,既脱除燃煤尾气中的SO2,又制得电池材料MnO2,实现了________。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
查看答案和解析>>
科目:高中化学 来源: 题型:
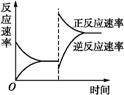
右图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )。
2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )。
A.升高温度,同时加压 B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度 D.增大反应物浓度,同时使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 )。
A.1 g H2和4 g O2反应放出71.45 kJ热量,则氢气的燃烧热为142.9 kJ·mol-1
B.在稀溶液中,H+aq)+OH-aq)===H2O1) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的氢氧化钠溶液混合,放出的热量大于57.3 kJ
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和CaOH)2反应的中和热ΔH=2×-57.3)kJ·mol-1
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com