
分析 (1)根据方程式,失电子的物质作负极;电解质溶液中含有得电子的Ag+;
(2)得电子的物质在正极上反应,结合方程式判断得电子的离子,从而写出电极反应式;
(3)根据正极反应式计算Ag的物质的量,带入m=nM计算质量.
解答 解:(1)原电池中失电子的物质作负极,根据反应方程式知,Cu作负极,电解质溶液中含有得电子的Ag+,可用硝酸银溶液作电解质溶液,
故答案为:AgNO3;
(2)在正极上银离子得电子生成银单质,电极反应式为Ag++e-=Ag,
故答案为:Ag++e-=Ag;
(3)由Ag++e-=Ag可知,导线上转移电子1mol,则生成1molAg,质量为1mol×108g/mol=108g,
故答案为:108.
点评 本题考查原电池的设计,题目难度不大,注意两极材料的判断以及电极反应式的书写方法.


科目:高中化学 来源: 题型:解答题
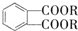 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
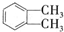 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该高聚物为加聚产物 | B. | 该高分子为体型高分子 | ||
| C. | 该高分子的单体有6种 | D. | 该高分子中含有酯基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的氧化物一定能溶于水 | |
| B. | R的最高价氧化物对应水化物是H2RO3 | |
| C. | R的氢化物的水溶液呈碱性 | |
| D. | R的氧化物都能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 淀粉、纤维素、聚乙烯、油脂、蛋白质都是高分子化合物 | |
| D. | 人们使用的装饰材料、内墙涂料释放出的甲醛是居室空气污染的主要来源之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com