
| A.含H+的溶液 |
| B.c(OH-)<c(H+)的溶液 |
| C.pH<7的溶液 |
| D.能与金属Al反应放出H2的溶液 |
 H++OH-,当c(OH-)= c(H+)时溶液显中性;当c(OH-)<c(H+)时,溶液显酸性。当c(OH-)> c(H+)时溶液显碱性。正确。C.在任何物质的稀溶液中都存在水的电离平衡:H2O
H++OH-,当c(OH-)= c(H+)时溶液显中性;当c(OH-)<c(H+)时,溶液显酸性。当c(OH-)> c(H+)时溶液显碱性。正确。C.在任何物质的稀溶液中都存在水的电离平衡:H2O H++OH-。在室温下在纯水中,c(OH-)·c(H+)=10-14.c(OH-)=c(H+)=10-7mol/L, pH=7;水的电离是个吸热过程,若升高温度促进水的电离,水的pH<7。所以pH<7的溶液不一定是酸性溶液。错误。D.Al既能与酸反应放出氢气,也能与碱反应放出氢气。反应的方程式为: 2Al+6HCl=2AlCl3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑。所以能与金属Al反应放出H2的溶液不一定是酸性溶液。错误。
H++OH-。在室温下在纯水中,c(OH-)·c(H+)=10-14.c(OH-)=c(H+)=10-7mol/L, pH=7;水的电离是个吸热过程,若升高温度促进水的电离,水的pH<7。所以pH<7的溶液不一定是酸性溶液。错误。D.Al既能与酸反应放出氢气,也能与碱反应放出氢气。反应的方程式为: 2Al+6HCl=2AlCl3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑。所以能与金属Al反应放出H2的溶液不一定是酸性溶液。错误。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.该溶液一定呈酸性 |
| B.该溶液一定呈碱性 |
| C.该溶液的pH可能约为1 |
| D.该溶液的pH可能约为13 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①=②=③ | B.①>②=③ |
| C.①<②=③ | D.①<②<③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2(g)+3H2(g) ΔH="+49.0" kJ·mol-1
CO2(g)+3H2(g) ΔH="+49.0" kJ·mol-1 CO2(g)+2H2(g) ΔH="-192.9" kJ·mol-1
CO2(g)+2H2(g) ΔH="-192.9" kJ·mol-1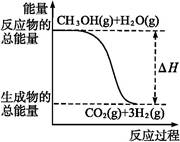
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的能量变化如上图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应CH3OH(l)+O2(g) CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图中曲线①表示NaOH溶液滴定盐酸时的pH变化 |
| B.酸溶液的体积均为10 mL |
| C.a点:c(CH3COOH)>c(CH3COO-) |
| D.a点:c(H+)+c(Na+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a=b+1 |
| B.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的c(NH4+) = c(Cl-) |
| C.25℃ 0.5×10-3 mol/L硫酸的pH=3.0,升高温度溶液pH增大 |
| D.100℃时,KW=10-12,若pH=1的盐酸与pH=11 NaOH溶液混合后,溶液的pH=6,则盐酸与NaOH溶液体积比为1∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com