
| A. | Z、W、M的原子半径由大到小的顺序为Z>W>M | |
| B. | M分别与Z、W所形成的物质的晶体类型相同 | |
| C. | X2Y2易溶于X2Y中,是由于X2Y2与X2Y能形成分子间氢键 | |
| D. | 将Z2Y在空气中加热可得到Z2Y2 |
分析 短周期元素X、Y、Z、W、M的原子序数依次增大,其中X与Y能形成两种物质,且常温下均为液体,可推知X为H元素、Y为O元素;X、Z同主族,Z原子序数大于氧,则Z为Na元素;Z、W、M同周期,处于第三周期,W的氧化物既能溶于强碱溶液,又能溶于X、M形成的水溶液,考虑该氧化物具有两性,W与M形成的物质在178℃时升华,该物质属于分子晶体,则W应为Al,M为Cl,验证符合,据此解答.
解答 解:短周期元素X、Y、Z、W、M的原子序数依次增大,其中X与Y能形成两种物质,且常温下均为液体,可推知X为H元素、Y为O元素;X、Z同主族,Z原子序数大于氧,则Z为Na元素;Z、W、M同周期,处于第三周期,W的氧化物既能溶于强碱溶液,又能溶于X、M形成的水溶液,考虑该氧化物具有两性,W与M形成的物质在178°C时升华,该物质属于分子晶体,则W应为Al,M为Cl,验证符合.
A.同周期随原子序数增大原子半径减小,故原子半径Z(Na)>W(Al)>M(Cl),故A正确;
B.M分别与Z、W所形成的物质为NaCl、AlCl3,前者属于离子晶体、后者属于分子晶体,二者晶体类型不同,故B错误;
C.由于H2O2与H2O能形成分子间氢键,H2O2易溶于H2O中,故C正确;
D.将Na2O在空气中加热,可以与氧气反应生成Na2O2,故D正确,
故选B.
点评 本题考查结构性质位置关系综合应用,推断元素是解题关键,注意对元素化合物性质的掌握及应用.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
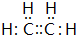 ,A的结构简式H2C=CH2.
,A的结构简式H2C=CH2. ,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.
,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、NaClO | B. | NaCl、NaClO3 | C. | NaClO、NaClO3 | D. | NaClO3、NaClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1NaClO溶液中含有的ClO-数目为NA | |
| B. | 常温常压下,11.2 L Cl2含氯原子数为NA | |
| C. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2和SO2 | B. | CO2和NH3 | C. | NO和SO2 | D. | NO2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )| A. | T1>T2,该反应的△H>0 | |
| B. | 加入催化剂可以提高CO的转化率 | |
| C. | T1时的平衡常数K1>T2时的平衡常数K2 | |
| D. | CO(g)+2H2(g)?CH3OH(1)的△H值将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗锌与稀硫酸反应比纯锌快,说明粗锌中含有更活泼的金属 | |
| B. | 新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色 | |
| C. | 常温下,弱酸酸式盐NaHA的pH=6,说明HA-的电离程度大于其水解程度 | |
| D. | 一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的△H<0,△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 实验 | 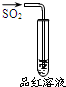 | 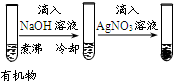 |  | 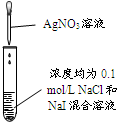 |
| 现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30秒不复原 | 出现白色沉淀 |
| 结论 | SO2有强氧化性 | 有机物中含有溴原子 | 滴定达到终点 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com