
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
科目:高中化学 来源: 题型:
【题目】将5mL物质的量浓度为18.4mol/L的浓硫酸加入水中,稀释成100mL溶液,所得稀硫酸的物质的量浓度是( )
A. 0.46mol/L B. 0.92mol/L C. 4.6mol/L D. 5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2-氯丙烷制取少量的1,2-丙二醇时,需要经过下列哪几步反应( )
A.消除、加成、取代B.加成、消除、取代
C.取代、消除、加成D.消除、加成、消除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min | 2 | 4 | 7 | 9 |
n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前4min的平均反应速率υ(Z)=0.0125molL-1min-1
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下 224 mL 某气体的质量为 0.32 g,该气体的摩尔质量为( )
A. 16 g·mol-1 B. 32 g·mol-1 C. 64 g·mol-1 D. 80 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ______。
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)═NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)═2H2O(1)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为 ______。
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
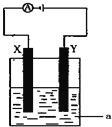
①若a为CuSO4溶液,则电解时的化学反应方程式为 ______ .通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() U是重要的核工业原料,它的浓缩一直被国际社会关注,有关
U是重要的核工业原料,它的浓缩一直被国际社会关注,有关 ![]() U说法正确的是( )
U说法正确的是( )
A.![]() U原子核中含有92个中子
U原子核中含有92个中子
B.![]() U原子核外有143个电子
U原子核外有143个电子
C.![]() 和
和 ![]() U互为同位素
U互为同位素
D.![]() U和
U和 ![]() U为同一核素
U为同一核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用海水制盐工业中的母液来生产金属镁的一种工艺流程如下:
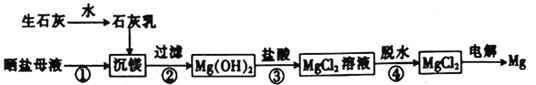
下列说法错误的是
A. 上述工艺流程中未涉及置换反应
B. 设计步骤①、②、③的主要目的是富集MgCl2
C. 脱水时在HC1气氛中进行可防止MgCl2发生水解
D. 电解得到的炽热镁粉可在二氧化碳气氛中冷却
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com