(1)0.5mol H2SO4 的质量是______g,含______个氧原子,能和______molNaOH完全反应,该硫酸所含氢元素的质量与______mol H3PO4或标准状况下______L HCl中所含氢元素的质量相同.
(2)某密闭容器的质量为50g,当装满CO2气体时,质量为58.8g,如果装满CH4气体时,此密闭容器的质量为______.
(3)已知某气体氧化物的分子式为R2O3,在标准状况下,7.6g该气体的体积是2240mL,则此氧化物的摩尔质量是______,R的相对原子质量是______.
解:(1)H
2SO
4的质量为0.5mol×98g/mol=49g,
氧原子数为0.5mol×4×6.02×10
23=1.204×10
24,
又H
++OH
-═H
2O,则需要的NaOH的物质的量为0.5mol×2=1mol,
设磷酸和HCl的物质的量分别为x、y,
由3H
2SO
4~2H
3PO
4~6HCl,则
3 2 6
0.5mol x y

,
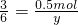
,解得x=

mol,y=1mol,
标准状况下HCl的体积为1mol×22.4L/mol=22.4L,
故答案为:49;1.204×10
24;1;

或0.333;22.4;
(2)气体的物质的量为
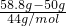
=0.2mol,
则装满甲烷时甲烷的质量为0.2mol×16g/mol=3.2g,
即装满CH
4气体时,此密闭容器的质量50g+3.2g=53.2g,
故答案为:53.2g;
(3)气体的物质的量为
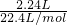
=0.1mol,
摩尔质量为
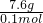
=76 g.mol
-1,
则氧化物的相对分子质量为76,设R的原子量为z,
2×z+16×3=76,解得z=14,
故答案为:76 g.mol
-1;14.
分析:(1)利用m=n×M来计算质量,利用构成来计算原子数,利用H
++OH
-═H
2O来计算需要的NaOH的物质的量,再根据3H
2SO
4~2H
3PO
4~6HCl来计算;
(2)因容器的体积相同,则气体的物质的量相等,利用n=

来计算;
(3)利用n=
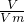
,M=

来计算摩尔质量,摩尔质量与相对分子质量的数值相等,单位不同.
点评:本题考查以物质的量为中心的计算,明确物质的量、质量、体积、摩尔质量及微观粒子数的关系即可解答,(2)是学生解答中的难点.

 ,
,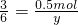 ,解得x=
,解得x= mol,y=1mol,
mol,y=1mol, 或0.333;22.4;
或0.333;22.4;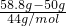 =0.2mol,
=0.2mol,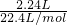 =0.1mol,
=0.1mol,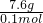 =76 g.mol-1,
=76 g.mol-1, 来计算;
来计算;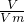 ,M=
,M= 来计算摩尔质量,摩尔质量与相对分子质量的数值相等,单位不同.
来计算摩尔质量,摩尔质量与相对分子质量的数值相等,单位不同.
