
| A. | 容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液 | |
| B. | 配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸 | |
| C. | 配制1 L 0.1 mol•L-1的NaCl溶液时用托盘天平称量5.85 g NaCl固体 | |
| D. | 定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁 |
科目:高中化学 来源: 题型:实验题
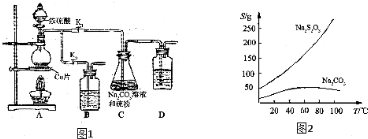
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
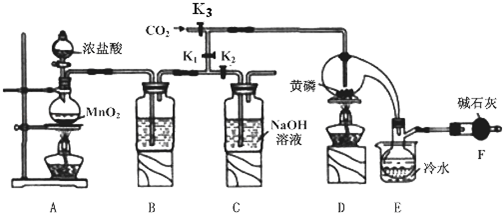
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)的键能之和大于2 mol SO3(g)的键能 | |
| B. | 如将一定量的SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| C. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| D. | 将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙在水中的溶解度很小,其水溶液电阻率很大,所以它是弱电解质 | |
| B. | 碳酸钙在水中的溶解度很小,但溶于水的碳酸钙完全电离,所以碳酸钙是强电解质 | |
| C. | 氯气与氨气的水溶液导电性好,所以他们是强电解质 | |
| D. | 液态的二氧化硫不导电,但溶于水后溶液导电,所以二氧化硫是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、NH3、蔗糖分别属于强电解质、弱电解质、非电解质 | |
| B. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 | |
| C. | H2SO3(aq)+2NaOH(aq)=Na2SO3(aq)+2H2O(l)△H>-114.6 kJ/mol | |
| D. | 由石墨比金刚石稳定可推知:C(石墨)═C(金刚石)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氨水中滴入盐酸:OH-+H+=H2O | |
| B. | 石灰乳与Na2CO3溶液反应:Ca2++CO32-=CaCO3↓ | |
| C. | 向澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| D. | 向沸水中逐滴滴加FeCl3饱和溶液:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3 H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据纯净物的元素组成,将纯净物分为单质和化合物 | |
| B. | 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 | |
| C. | 根据能水溶液能否电离出氢离子,来判断化合物是否是酸 | |
| D. | 根据是否含金属元素,来判断氧化物是否是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡后,保持容器的体积不变再充入ClF3气体的瞬间,体系压强增大,平衡右移 | |
| B. | 若c(F2):c(ClF):c(ClF3)=1:1:1,则反应一定达到平衡状态 | |
| C. | 达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移 | |
| D. | 平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的平均摩尔质量增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com