
| A、c(H+)=c(OH-)=10-6 mol?L-1 溶液 |
| B、pH=7的溶液 |
| C、滴入酚酞呈无色的溶液 |
| D、酸与碱恰好完全反应生成正盐的溶液 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、c(N2):c(H2):c(NH3)=1:3:2 |
| B、一个N≡N 断裂的同时,有3个H-H生成 |
| C、其他条件不变时,混合气体的密度不再改变 |
| D、v正(N2)═2 v逆(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 事 实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | NaHCO3溶液与Na[Al(OH)4]溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| C | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| D | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由C(s,石墨)→C(s,金刚石)△H=+1.9kJ?mol-1可知,石墨比金刚石稳定 |
| B、在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(1)△H=-285.8kJ?mol-1 |
| C、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| D、压缩容器的体积,平衡2SO2+O2?2SO3正向移动,该反应的△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
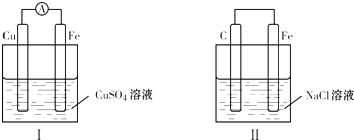
| A、装置Ⅰ:铁极会溶解,溶液从蓝色逐渐变成浅绿色 |
B、装置Ⅰ:电流方向由铁极→ →铜极 →铜极 |
| C、装置Ⅱ:碳极上有无色气体产生 |
| D、装置Ⅱ:铁极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、CO32-、NO3- |
| B、Ag+、Cl-、Fe3+、HCO3- |
| C、Fe2+、H+、K+、MnO4- |
| D、Mg2+、Br-、NH4+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同质量的热水比冷水含有更多的热量 |
| B、化学反应限度大,该反应的速率也大 |
| C、在相同条件下,分子破裂为原子所吸收的能量与相应原子结合成分子所放出的能量数值相同 |
| D、化石燃料的开采与使用,有利于节能减排与保护环境 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com