
| A. | 二氧化氮 | B. | 钠 | C. | 硫酸镁 | D. | 二氧化硅 |
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、Al3+、CH3COO- | B. | Mg2+、HCO3-、Ca2+、NO3- | ||
| C. | K+、SO42-、Cl-、Cu2+ | D. | NH4+、Cl-、K+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
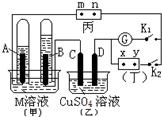 如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:
如图所示的实验装置,丙为酚酞溶液润湿的淀粉碘化钾试纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A极产生的气体体积为44.8ml、B极产生的气体体积为22.4ml(都已换算成标况下的体积),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
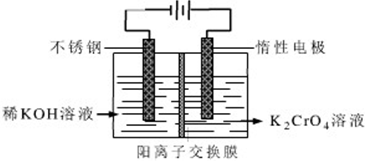
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
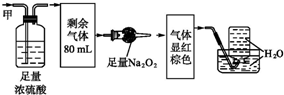
| A. | NH320ml、NO240ml、N240ml | B. | NH3 20ml、NO32ml、CO248ml | ||
| C. | NH320ml、NO20ml、CO260ml | D. | NH320ml、CO228ml、NO52ml |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com