
����25�������½�pH=11�İ�ˮϡ��100������Һ��pHΪ������ţ�__ __��
A��9 B��13 C��11��13֮�� D��9��11֮��
��25��ʱ����0.1mol/L�İ�ˮ�м��������Ȼ�粒��壬�������ܽ�����ҺpH��С����Ҫԭ���ǣ�����ţ�__ ___��
A����ˮ���Ȼ�立�����ѧ��Ӧ
B���Ȼ����Һˮ�������ԣ�������c(H+)
C���Ȼ������ˮ���������������ӣ������˰�ˮ�ĵ��룬ʹc(OH�D)��С
����֪ij��Һ��ֻ����OH����H+��NH4+��Cl���������ӣ�ijͬѧ�Ʋ����Һ�и�����Ũ�ȴ�С˳��������������ֹ�ϵ��
A��c(Cl��)��c(NH4+)��c(H+)��c(OH��) B��c(Cl��)��c(NH4+)��c(OH��)��c(H+)
C��c(Cl��)��c(H+)��c(NH4+)��c(OH��) D��c(NH4+)��c(Cl��)��c(OH��)��c(H+)
������Һ��ֻ�ܽ���һ�����ʣ��������� ����������Ũ�ȴ�С˳���ϵ����ȷ���ǣ�ѡ����ţ� ��
����������ϵ��C����ȷ�ģ�����Һ�������� ��
��10�֣���D��2�֣� ��C��2�֣� �� �� �Ȼ�� ��A ����2�֣� �� NH4Cl��HCl ��2�֣�
���������������1����ˮ�����ϡ�ʹٽ����룬OH�������ʵ��������ӵġ�������25�������½�pH=11�İ�ˮϡ��100������Һ��pH����9��11֮�䣬��ѡD��
��2���Ȼ������ˮ���������������ӣ������˰�ˮ�ĵ��룬ʹc(OH�D)��С�����Դ�ѡC��
��3�����ݵ���غ�c��NH4+����c��H+����c��OH������c��Cl������֪��
������Һ��ֻ�ܽ���һ�����ʣ����������Ȼ�李��Ȼ��ˮ�⣬��Һ�����ԣ�������������Ũ�ȴ�С˳���ϵ����ȷ����A��
��C����Һ�����ԣ���c(H+)��c(NH4+)��������Һ���������Ȼ�����Ȼ�李�
���㣺������������Ե���ƽ���Ӱ���Լ���Һ������Ũ�ȴ�С�Ƚ�
�����������Ǹ߿��еij������ͣ������е��Ѷȵ����⡣�����ۺ���ǿ�����ض�ѧ������֪ʶ�Ĺ�����ѵ��������������ѧ�������������������ѧ��������û���֪ʶ���ʵ�����������������Ĺؼ������ú���Һ�еļ����غ��ϵ���������غ㡢����غ�������غ㡣


 ÿ�α���ϵ�д�
ÿ�α���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ���� | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| �е�/�� | 57.7 | 12.8 | - | 315 | - |
| �۵�/�� | -70.0 | -107.2 | - | - | - |
| �����¶�/�� | - | - | 180 | 300 | 162 |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
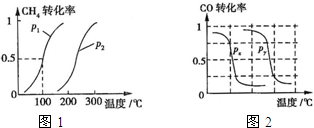 ��2013?����ģ�⣩�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2OΪԭ�ϣ�ͨ��������Ӧ��͢����Ʊ��״���
��2013?����ģ�⣩�״���һ�ֺܺõ�ȼ�ϣ���ҵ����CH4��H2OΪԭ�ϣ�ͨ��������Ӧ��͢����Ʊ��״���| ʵ���� | T���棩 | n��CO��/n��H2�� | p��MPa�� | ||
| l | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
| 1 |
| 3 |
| 1 |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ʵ���� | T���棩 | n��CO��/n��H2�� | P��MPa�� | ||||
| i | 150 |
|
0.1 | ||||
| ii | 150 150 |
|
5 | ||||
| iii | 350 |
|
5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ������ʡ�����йٶ������и߶�9���¿���ѧ�Ծ����������� ���ͣ�������
(��16��)
(1)���з�Ӧ��mA(g)��nB(g)  pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
�ٸ÷�Ӧ���淴ӦΪ______��Ӧ(����ȡ����ȡ�)����m��n______ p (�>������������<��)��
�ڼ�ѹʹ�����������ʱ��A����������________��(���������С�����䡱����ͬ)
�����ݻ��������B����A��ת����__________��B��ת����________��
���������¶ȣ���ƽ��ʱB��C��Ũ��֮�� ��________��
��________��
�������������ƽ��ʱ��������������ʵ���________________________________
(2)��һ�ݻ�Ϊ2 L���ܱ������У�����0.2 mol��N2��0.6 mol��H2����һ�������·������·�Ӧ��
N2(g)��3H2(g) 2NH3(g)����H<0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ����ش��������⣺
2NH3(g)����H<0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ����ش��������⣺
�ڵ�5 minĩ�������������Сһ������ڵ�8 minĩ�ﵽ�µ�ƽ��(��ʱNH3��Ũ��ԼΪ0.25 mol��L��1)������ͼ�л�����5 minĩ��ƽ��ʱNH3Ũ�ȵı仯���ߡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014������ʡ�����и߶�9���¿���ѧ�Ծ��������棩 ���ͣ�������
(��16��)
(1)���з�Ӧ��mA(g)��nB(g)  pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C������������С����
�ٸ÷�Ӧ���淴ӦΪ______��Ӧ(����ȡ����ȡ�)����m��n______ p (�>������������<��)��
�ڼ�ѹʹ�����������ʱ��A����������________��(���������С�����䡱����ͬ)
�����ݻ��������B����A��ת����__________��B��ת����________��
���������¶ȣ���ƽ��ʱB��C��Ũ��֮��  ��________��
��________��
�������������ƽ��ʱ��������������ʵ���________________________________
(2)��һ�ݻ�Ϊ2 L���ܱ������У�����0.2 mol��N2��0.6 mol��H2����һ�������·������·�Ӧ��
N2(g)��3H2(g) 2NH3(g)����H<0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ����ش��������⣺
2NH3(g)����H<0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ����ش��������⣺

�ڵ�5 minĩ�������������Сһ������ڵ�8 minĩ�ﵽ�µ�ƽ��(��ʱNH3��Ũ��ԼΪ0.25 mol��L��1)������ͼ�л�����5 minĩ��ƽ��ʱNH3Ũ�ȵı仯���ߡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com