
【题目】某温度下,分别向20mL浓度均为xmol/L的NaCl和Na2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加过程中![]() 和
和![]() 与AgNO3溶液的体积关系如图所示。下列说法不正确的是
与AgNO3溶液的体积关系如图所示。下列说法不正确的是
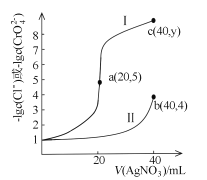
A.x =0.1B.曲线I代表NaCl溶液
C.Ksp(Ag2CrO4)约为4×10-12D.y=9
【答案】D
【解析】
A.根据图像可知,未滴加AgNO3溶液时![]() 或
或![]() 均为1,则NaCl和Na2CrO4溶液均为0.1mol·L-1,即x=0.1,A选项正确;
均为1,则NaCl和Na2CrO4溶液均为0.1mol·L-1,即x=0.1,A选项正确;
B.1molCl-和CrO42-分别消耗1mol和2molAg+,由图像可知,滴加AgNO3溶液过程中,曲线I突跃时加入的AgNO3溶液的体积为20mL,则曲线I代表NaCl溶液,B选项正确;
C.b点时,![]() =4,则c(CrO42-)=10-4mol·L-1,c(Ag+)=2×10-4mol·L-1,Ksp(Ag2CrO4)= c(CrO42-)·c2(Ag+)=4×10-12,C选项正确;
=4,则c(CrO42-)=10-4mol·L-1,c(Ag+)=2×10-4mol·L-1,Ksp(Ag2CrO4)= c(CrO42-)·c2(Ag+)=4×10-12,C选项正确;
D.a点时,Cl-恰好完全沉淀,![]() =5,则c(Cl-)=10-5mol·L-1,c(Ag+)=10-5mol·L-1,Ksp(AgCl)=c(Cl-)·c(Ag+)=10-10,c点加入40mLAgNO3溶液,溶液中
=5,则c(Cl-)=10-5mol·L-1,c(Ag+)=10-5mol·L-1,Ksp(AgCl)=c(Cl-)·c(Ag+)=10-10,c点加入40mLAgNO3溶液,溶液中![]() ,
,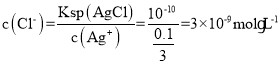 ,则-lgc(Cl-)=9-lg3≈8.52,D选项错误;
,则-lgc(Cl-)=9-lg3≈8.52,D选项错误;
答案选D。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 碳氢质量比为3:1的有机物一定是甲烷
D. 处在不同化学环境中的氢原子在核磁共振氢谱图上出现的位置不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
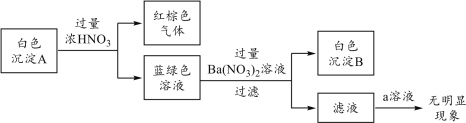
请回答:
①根据白色沉淀B是__(填化学式),判断沉淀A中一定存在CuSCN。
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__。
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__(填化学式)。
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_Cu2++_SCN-=_CuSCN↓+_(SCN)2
⑤结合上述过程以及Fe(SCN)3![]() Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__。
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__或__。
查看答案和解析>>
科目:高中化学 来源: 题型:
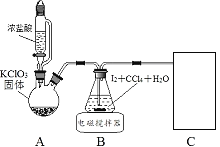
【题目】碘酸钾(![]() )是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中
)是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中![]() 的纯度:
的纯度:
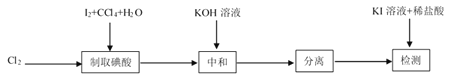
其中制取碘酸(![]() )的实验装置见图,有关物质的性质列于表中
)的实验装置见图,有关物质的性质列于表中
物质 | 性质 |
HIO3 | 白色固体,能溶于水,难溶于CCl4 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生氧化反应:ClO-+IO3-=IO4-+Cl- |
回答下列问题
(1)装置A中参加反应的盐酸所表现的化学性质为______________。
(2)装置B中反应的化学方程式为___________________ 。B中所加CCl4的作用是_________从而加快反应速率。
(3)分离出B中制得的![]() 水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低
水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低![]() 的产率。
的产率。
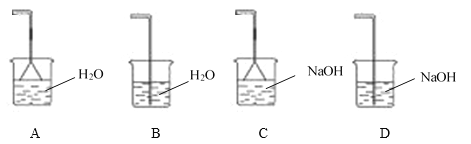
(4)为充分吸收尾气,保护环境,C处应选用最合适的实验装置是____________(填序号)。
(5)为促使![]() 晶体析出,应往中和所得的
晶体析出,应往中和所得的![]() 溶液中加入适量的___________。
溶液中加入适量的___________。
(6)取1.000g![]() 产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L
产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L![]() 溶液滴定。滴定至终点时蓝色消失(
溶液滴定。滴定至终点时蓝色消失(![]() ),测得每次平均消耗
),测得每次平均消耗![]() 溶液25.00mL。则产品中
溶液25.00mL。则产品中![]() 的质量分数为___(结果保留三位有效数字)。
的质量分数为___(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Garnet型固态电解质被认为是锂电池最佳性能固态电解质。LiLaZrTaO材料是目前能达到最高电导率的Garnet型电解质。某Garnet型可充电锂电池放电时工作原理如图所示,反应方程式为:LixC6+Li1-xLaZrTaO![]() LiLaZrTaO+6C,下列说法不正确的是
LiLaZrTaO+6C,下列说法不正确的是
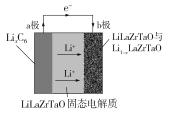
A.放电时,a极为负极,发生氧化反应
B.LiLaZrTaO固态电解质起到传导Li+的作用
C.充电时,b极反应为:LiLaZrTaO -xe-=xLi++Li1-xLaZrTaO
D.充电时,每转移xmol电子,a极增重7 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量比较丰富的一种元素,氮的化合物在工业生产和生活中有重要的作用。
I.已知298K时,发生反应:N2O4(g) ![]() 2NO2(g)
2NO2(g)
(1)反应达到平衡后,压缩容器的体积,再次达到平衡时混合气体的颜色 ____(填“变深”、“变浅”或“不变”)。
(2)恒容密闭容器中发生上述反应,已知v正=k正·p(N2O4),v逆=k逆·p2(NO2),Kp=___________(用k正、k逆表示)。若初始压强为100kPa,k正=2.8×104s-1,当NO2的体积分数为40%时,v正=__________kPa·s-1。[其中p(N2O4)和p(NO2)分别是N2O4和NO2的分压,分压=p总×气体体积分数,k正、k逆为速率常数]
Ⅱ.在催化剂作用下,H2可以还原NO消除污染,反应为:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=akJ·mol-1
N2(g)+2H2O(g) △H=akJ·mol-1
(3)若每生成7g N2放出166kJ的热量,则a=____。
(4)该反应分两步进行:
①2NO(g)+H2(g)![]() N2(g)+H2O2(g) △H1
N2(g)+H2O2(g) △H1
②H2O2(g)+H2(g)![]() 2H2O(g) △H2
2H2O(g) △H2
已知:i.总反应分多步进行时,较慢的一步决定总反应速率;
III.总反应的速率表达式v=kc2(NO)·c(H2)(k为速率常数,只和温度有关)。由上述信息可知,正反应的活化能较低的是____(填“①”或“②”)。
(5)将2molNO和1molH2充入一个恒容的密闭容器中,经相同时间测得N2的体积分数与温度的关系如图所示。低于900K时,N2的体积分数_____(填“是”或“不是”)对应温度下平衡时的体积分数,原因是_____。高于900K时,N2的体积分数降低的可能原因是____。
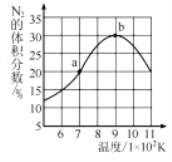
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①Na2CO3溶液 ②NaOH固体 ③CO2 ④石墨 ⑤熔融BaCl2五种物质,按要求回答下列问题:
(1)属于电解质的是____________(填代号,下同);属于非电解质的是____________;能导电的是______________。
(2)上述物质中有些物质在一定条件下可以反应,请按要求写出相应的化学方程式:
①是化合反应,也是氧化还原反应_________________________________。
②是化合反应,不是氧化还原反应_________________________________。
③是复分解反应,且有沉淀生成__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1840年,Devil用干燥的氯气通过干燥的硝酸银制得了N2O5。
(1)F.DanielS等曾利用测压法在刚性反应器中研究了特定条件下N2O5(g)分解反应:
已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=-4.4kJmol-1
2NO2(g)=N2O4(g) ΔH2=-55.3kJmol-1
则反应N2O5(g)=2NO2(g)+![]() O2(g)的ΔH=__kJmol-1。
O2(g)的ΔH=__kJmol-1。
(2)查阅资料得知N2O5是硝酸的酸酐,常温呈无色柱状结晶体,微溶于冷水,可溶于热水生成硝酸,熔点32.5℃,受热易分解,很容易潮解,有毒。在通风橱中进行模拟实验制取N2O5的装置如图:
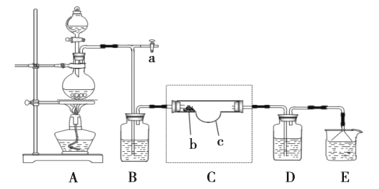
注:虚线框内为该组同学自制特殊仪器,硝酸银放置在b处。
请回答下列问题:
①实验开始前,需要打开a处活塞并鼓入空气,目的是__。
②经检验,氯气与硝酸银反应的产物之一为氧气,写出此反应的化学反应方程式__。
③实验时,装置C应保持在35℃,可用的方法是__。
④能证明实验成功制得N2O5的现象是__。
⑤装置D中的试剂是__,作用是__。
⑥装置E烧杯中的试剂为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为单质,C为化合物。能实现上述转化关系的是( )
A+B![]() C
C![]() C溶液
C溶液![]() A+B
A+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显血红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①②B.③④C.①③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com