
| A. | NH4Cl | B. | Mg(HCO3)2 | C. | H2SO4 | D. | MgCl2 |
分析 由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-离子之间能够反应生成的沉淀有:BaSO4、BaCO3、Mg(OH)2;而甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成,所以甲只能是Ba(OH)2,以此解答该题.
解答 解:八种离子NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中能够形成的白色沉淀只有:BaSO4、BaCO3、Mg(OH)2,而甲溶液能够与其它各物质生成三种沉淀,所以甲中一定含有Ba2+和OH-,即甲为Ba(OH)2,那么乙丙丁均能与甲生成沉淀,那么乙丙丁中应分别含有Mg2+、HCO3-、SO42-中的一种,氢氧化钡与氯化铵反应不生成沉淀,
故选A.
点评 本题考查离子共存的正误判断,该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验,本题解题关键是先找出离子之间能够形成的白色沉淀.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
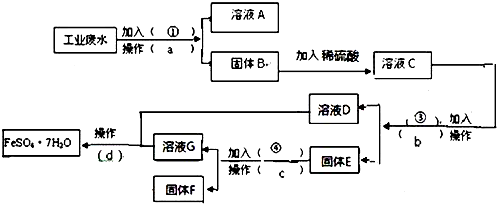
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
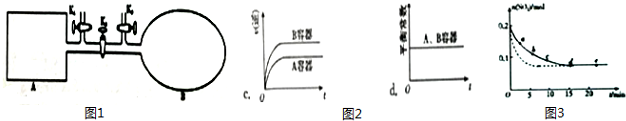
| 编号 | a | b | c | d | e |
| n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
| t/min | 2 | 5 | 8 | 15 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 家庭用的“84”消毒液与洁厕灵能混合使用,不会发生中毒事故 | |
| C. | 可用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气 | |
| D. | 硅胶可用作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯中存在的电子总数为12NA | |
| B. | 标准状况下,22.4LHF的物质的量为1mol | |
| C. | 铅蓄电池电解氯化钠溶液,得到标况下22.4L氢气,理论上铅蓄电池中消耗氢离子个数为4NA | |
| D. | lmol的Na2C03溶于盐酸形成混合溶液1L,常温下在pH=4时,c(CO32- )+c(H2C03)=0.lmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:
A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 酸性KMnO4溶液中通入SO2:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | AgCl悬浊液中通HI:Ag++HI═AgI↓+H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com