
| A. | B单质比A单质稳定 | |
| B. | B单质和A单质互为同分异构体 | |
| C. | A单质中化学键的键能比B单质中的大 | |
| D. | 等量的A和B,A单质的内能高 |
分析 A、物质的能量越低越稳定;
B、B单质和A单质为同种元素组成的不同单质,为同素异形体;
C、根据△H=反应物键能和-生成物键能和判断;
D、从A(单质)=B(单质),△H>0吸热,则A的能量比B的能量低.
解答 解:A、A(单质)=B(单质),△H>0吸热,则A的能量比B的能量低,物质的能量越低越稳定,所以A稳定,故A错误;
B、B单质和A单质为同种元素组成的不同单质,为同素异形体,故B错误;
C、△H=反应物键能和-生成物键能和,△H>0说明A单质中化学键的键能比B单质中的大,故C正确;
D、A(单质)=B(单质),△H>0吸热,则A的能量比B的能量低,故D错误;
故选C.
点评 本题考查同素异形体之间的转化,注意△H=反应物键能和-生成物键能和,能量越低越稳定,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、酒精、甲烷等含碳化合物称为有机物 | |
| B. | 由金属离子和酸根离子组成的化合物称为盐 | |
| C. | 在水溶液中电离出的阳离子全部为氢离子的化合物 | |
| D. | 含氧元素的化合物称为氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变单位中kJ•mol-1,是指1 mol物质参加反应时的能量变化 | |
| B. | 反应热的大小与反应的途径有关,无论是一步完成还是分几步完成,其反应热基本相同 | |
| C. | 一个化学反应中,反应物的总键能大于生成物的总键能时,反应吸热,△H>0 | |
| D. | 一个化学反应中,反应物的总能量小于生成物的总能量时,反应放热,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯(液溴):加NaOH溶液,充分振荡,分液,留下层液体 | |
| B. | 乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤取溶液即可 | |
| C. | 乙烷(乙烯):通过盛有足量溴水溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,留上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯是纯净物 | |
| B. | 合成聚氯乙烯的单体是CH2=CH-Cl | |
| C. | 聚氯乙烯的长链上含有碳碳双键 | |
| D. | 聚氯乙烯分子中的化学键在自然界中容易断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测得容器内压强增大p%,A的转化率也是p% | |
| B. | 恒容容器内平衡后再充入A(g),此平衡逆向移动 | |
| C. | 恒容容器内平衡后再充入等量的A(g),达到新平衡后,容器内压强p’为原平衡容器压强p的2倍 | |
| D. | 恒压容器内平衡后再充入Ar(g),A的转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.金属的腐蚀主要有两种形式:化学腐蚀和电化学腐蚀,其中电化学腐蚀是金属腐蚀的主要形式.如图是钢铁在空气中发生电化学腐蚀(吸氧腐蚀)的简单图示.试分析下列问题:
金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.金属的腐蚀主要有两种形式:化学腐蚀和电化学腐蚀,其中电化学腐蚀是金属腐蚀的主要形式.如图是钢铁在空气中发生电化学腐蚀(吸氧腐蚀)的简单图示.试分析下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
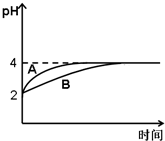 中学化学中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒•夏特列原理.请回答下列问题:
中学化学中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒•夏特列原理.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com