
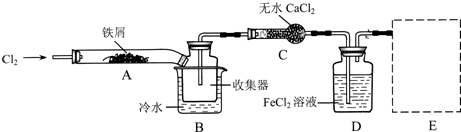
ĀČĘųŌŚæĘ¼¼”¢Éś²śÖŠÓ¦ÓĆ¹ć·ŗ”£
£Ø1£©¹¤ŅµÉĻ³£ÓĆŹģŹÆ»ŅŗĶĀČĘų·“Ó¦ÖĘČ”ĘÆ°×·Ū£¬»Æѧ·½³ĢŹ½ŹĒ ”£
£Ø2£©ŹµŃéŹŅÓĆMnO2ÓėÅØŃĪĖį·“Ó¦ÖĘČ”ĀČĘųµÄŌĄķČēĻĀ£ŗMnO2
+ 4HCl MnCl2 + Cl2ӟ+ 2H2O
MnCl2 + Cl2ӟ+ 2H2O
¢ŁČōÖĘČ”11.2 L Cl2£Ø±ź×¼×“æö£©£¬Ōņ×īÉŁÓ¦¼ÓČėMnO2µÄÖŹĮæĪŖ______g”£
¢ŚÓĆĘ½ŗāŅʶÆŌĄķ½āŹĶæÉÓĆÅű„ŗĶŹ³ŃĪĖ®·ØŹÕ¼ÆĀČĘųµÄŌŅņ ”££Ø½įŗĻ±ŲŅŖµÄ»ÆѧÓĆÓļ¼°ĪÄ×Ö»Ų“š£©
¢ŪÖʱøĀČĘųŹ±£¬æÉÓĆNaOHČÜŅŗĪüŹÕĪ²Ęų£¬ĻĀĮŠŹŌ¼ĮŅ²æÉÓĆÓŚĪüŹÕĀČĘųµÄŹĒ____£ØĢī×ÖÄø£©”£
a. KIČÜŅŗ b. FeCl2ČÜŅŗ c. KClČÜŅŗ
Š“³öÄćŃ”ŌńµÄĪüŹÕŹŌ¼ĮÓėCl2·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ_______”£
¢ÜŅ²æÉÓĆÅØ°±Ė®ĪüŹÕĀČĘų£¬Ķ¬Ź±Éś³ÉŅ»ÖÖĪŽĪŪČ¾µÄĘųĢ壬·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ_______”£
£Ø1£©2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
£Ø2£©¢Ł43.5£»¢ŚCl2ČÜÓŚĖ®ÓėĖ®·“Ó¦£¬Cl2+H2O HClO+HCl£¬±„ŗĶµÄŹ³ŃĪĖ®ÖŠ“ęŌŚ“óĮæµÄCl-£¬Ę½ŗāĻņ×óŅĘ¶Æ£¬Ź¹Cl2µÄČܽā¶Č¼õŠ”£¬ĖłŅŌ£¬æÉÓĆÅű„ŗĶŹ³ŃĪĖ®·ØŹÕ¼ÆCl2”£¢Ūab øł¾ŻŃõ»Æ»¹Ō·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖ£ŗ Cl2+2I-=2 Cl-+I2”¢Cl2+2Fe2+= 2Fe3++2Cl-£»¢Ü3Cl2+8NH3=6NH4Cl+N2£Ø»ņ3Cl2+2NH3=6HCl+N2»ņŠ“³ÉŅ»Ė®ŗĻ°±Ņ²ŠŠ£©”£
HClO+HCl£¬±„ŗĶµÄŹ³ŃĪĖ®ÖŠ“ęŌŚ“óĮæµÄCl-£¬Ę½ŗāĻņ×óŅĘ¶Æ£¬Ź¹Cl2µÄČܽā¶Č¼õŠ”£¬ĖłŅŌ£¬æÉÓĆÅű„ŗĶŹ³ŃĪĖ®·ØŹÕ¼ÆCl2”£¢Ūab øł¾ŻŃõ»Æ»¹Ō·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖ£ŗ Cl2+2I-=2 Cl-+I2”¢Cl2+2Fe2+= 2Fe3++2Cl-£»¢Ü3Cl2+8NH3=6NH4Cl+N2£Ø»ņ3Cl2+2NH3=6HCl+N2»ņŠ“³ÉŅ»Ė®ŗĻ°±Ņ²ŠŠ£©”£
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ
£Ø1£©¹¤ŅµÉĻÓĆŹģŹÆ»ŅŗĶĀČĘų·“Ó¦ÖĘČ”ĘÆ°×·ŪµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2Cl2+2Ca(OH)2£½CaCl2+Ca(ClO)2+2H2O£»
£Ø2£©¢ŁÉčMnO2µÄÖŹĮæĪŖX
MnO2 + 4HCl MnCl2 + Cl2ӟ+ 2H2O
MnCl2 + Cl2ӟ+ 2H2O
87g 22.4L
X 11.2L
X=43.5g
¢ŚCl2ŌŚĖ®ČÜŅŗÖŠ“ęŌŚ£ŗCl2+H2O HClO+HCl£¬±„ŗĶµÄŹ³ŃĪĖ®ÖŠ“ęŌŚ“óĮæµÄCl-£¬ŅÖÖĘĮĖĀČĘųµÄČܽā,Ź¹»ÆŃ§Ę½ŗā×óŅĘ£¬ĀČĘųµÄČܽā¶Č¼õŠ””£¢ŪCl2+2I-=2 Cl-+I2”¢Cl2+2Fe2+= 2Fe3++2Cl-
¢ÜĀČĘųÓŠĒæ»ÆŠŌ”¢°±ĘųÓŠ»¹ŌŠŌ£¬¶žÕß·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬»Æѧ·½³ĢŹ½ĪŖ3Cl2+8NH3=6NH4Cl+N2£¬»ņ3Cl2+2NH3=6HCl+N2”£
HClO+HCl£¬±„ŗĶµÄŹ³ŃĪĖ®ÖŠ“ęŌŚ“óĮæµÄCl-£¬ŅÖÖĘĮĖĀČĘųµÄČܽā,Ź¹»ÆŃ§Ę½ŗā×óŅĘ£¬ĀČĘųµÄČܽā¶Č¼õŠ””£¢ŪCl2+2I-=2 Cl-+I2”¢Cl2+2Fe2+= 2Fe3++2Cl-
¢ÜĀČĘųÓŠĒæ»ÆŠŌ”¢°±ĘųÓŠ»¹ŌŠŌ£¬¶žÕß·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬»Æѧ·½³ĢŹ½ĪŖ3Cl2+8NH3=6NH4Cl+N2£¬»ņ3Cl2+2NH3=6HCl+N2”£
æ¼µć£ŗæ¼²éĀČĘųµÄ»ÆѧŠŌÖŹ¼°ÖĘČ””¢»Æѧ¼ĘĖć”£


 ³õ֊ѧŅµæ¼ŹŌµ¼ÓėĮ·ĻµĮŠ“š°ø
³õ֊ѧŅµæ¼ŹŌµ¼ÓėĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| Ń”Ļī | ³ĀŹö¢ń | ³ĀŹö¢ņ | ÅŠ¶Ļ | A | ĢśŹĒµŲæĒÖŠŗ¬Įæ×īøßµÄ ½šŹōŌŖĖŲ |
ĢśŹĒČĖĄą×īŌēŹ¹ÓĆµÄ½šŹō²ÄĮĻ | ¢ń¶Ō£»¢ņ¶Ō£»ÓŠ | B | ³£ĪĀĻĀĢśÓėĻ”ĮņĖį·“Ó¦ Éś³ÉĒāĘų |
øßĪĀĻĀĒāĘųÄÜ»¹ŌŃõ»Æ ĢśµĆµ½Ģś |
¢ń¶Ō£»¢ņ¶Ō£»ĪŽ | C | ĢśŹōÓŚ¹ż¶ÉŌŖĖŲ | ĢśŗĶĢśµÄijŠ©»ÆŗĻĪļæÉÓĆ×÷“߻ƼĮ | ¢ń“ķ£»¢ņ¶Ō£»ĪŽ | D | ŌŚæÕĘųÖŠĢśµÄ±ķĆęÄÜŠĪ ³ÉÖĀĆܵÄŃõ»ÆĤ |
Ģś²»ÄÜÓėŃõĘų·“Ó¦ | ¢ń¶Ō£»¢ņ¶Ō£»ÓŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| ||
| ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ŹµŃé ±ąŗÅ |
T/K | pH | c/10-3mol?L-1 | |
| H2O2 | Fe2+ | |||
| ¢ń | 298 | 3 | 6.0 | 0.30 |
| ¢ņ | 313 | 3 | 6.0 | 0.30 |
| ¢ó | 298 | 10 | 6.0 | 0.30 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com