
用已知物质的量浓度的酸测定未知物质的量浓度的碱时,会导致待测碱液的物质的量浓度偏低的操作是( )
①酸式滴定管在滴定前未将液面调至“0”刻度,而调在“2.40” ②碱式滴定管用蒸馏水洗后,未用待测液润洗
③滴定前酸式滴定管尖嘴部分未充满溶液,滴定后充满溶液 ④滴定中不慎将锥形瓶内液体摇出瓶外 ⑤滴定达终点时,视线高于滴定管内液面凹面的最低点
A.①②④ B.②③④
C.②③⑤ D.②④⑤
 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是( )
A.常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有
c (Na+) + c(H+) = c(OH-) + c(CH3COO-)
B.对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
C.常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
D.常温下,已知醋酸电离平衡常数为Ka,醋酸根水解平衡常数为Kh,水的离子积为Kw,则有:Ka∶Kh=Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中的能量变化,通常表现为热量变化,如Ba(OH)2·8H2O与NH4Cl的反应需要吸收热量,在化学上叫做吸热反应。其原因是( )
A.反应物所具有的总能量高于生成物所具有的总能量
B.反应物所具有的总能量低于生成物所具有的总能量
C.该反应不需要加热,不可能是吸热反应
D.在化学反应中需要加热的反应才是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。
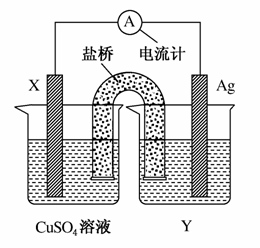
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________。
(2)银电极为电池的________极,发生的电极反应为__________________;X电极上发生的电极反应为________________________________。
(3)外电路中的电子是从________电极流向________电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
能表明NH3·H2O是弱电解质的叙述是( )
A.NH3·H2O的导电性比NaOH溶液弱得多
B.0.1 mol·L-1NH3·H2O的pH大于7
C.(NH4)2SO4的水溶液,其pH小于7
D.5 mL1 mol·L-1的NH3·H2O跟10 mL0.5 mol·L-1的HCl恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
向体积为Va的0.05 mol·L-1 CH3COOH溶液中加入体积为Vb的0.05 mol·L-1 KOH溶液,下列关系错误的是( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B. Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C. Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D. Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
现有电解质溶液:①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH,且已知:CO2+3H2O+2AlO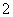 ===2Al(OH)3↓+CO
===2Al(OH)3↓+CO 。
。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是__________________。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,其pH变化最大的是________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,有气体产生的是________(填编号)。
(4)将上述①②③④四种电解质溶液混合时,发生反应的离子方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组内物质,无论以任何比例混合,只要混合物的总质量一定,完全燃烧时耗O2量不变的是( )
A.C2H4和C2H6
B.C2H2和C6H6
C.CH3CH2OH和CH3CHO
D.CH3COOH和CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
A元素原子的核电荷数为11,B元素原子的核电荷数为8,A与B化合形成化合物Z,下列说法中错误的是( )
A.A形成正一价阳离子
B.Z一定能与水反应
C.Z一定能与CO2反应
D.Z一定是M2O型离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com