
| A. | Cu | B. | Na | C. | Fe | D. | Zn |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
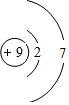 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 漂白粉在空气中久置 | 漂白粉变为块状 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| B | 用坩埚钳夹住点燃的镁条伸入二氧化碳气体中 | 镁条剧烈燃烧 | 二氧化碳作还原剂 |
| C | 向1.0mol•L-1的NaHCO3溶液中滴加2滴甲基橙 | 溶液呈黄色 | NaHCO3溶液呈碱性 |
| D | 向浓度均为0.1mol•L-1的Al2(SO4)3、Fe2(SO4)3的溶液中逐滴加入氨水 | 先有红褐色沉淀生成,后有白色色沉淀生成 | Al(OH)3的溶度积比Fe(OH)3的大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子组 | 加入试剂 | 离子方程式 | |
| A | Al3+、SO42- | 适量Ba(OH)2溶液 | Al3++3OH-═Al(OH)3↓ |
| B | Fe2+、I- | 足量新制氯水 | Cl2+2I-═2Cl-+I2 |
| C | Fe3+、NO3- | NaHSO3溶液 | 3SO32-+2NO3-+2H+═3SO42-+2NO↑+H2O |
| D | Ca2+、HCO3- | 氨水 | Ca2++2HCO3-+2NH3•H2O═CaCO3↓+CO32-+2NH4++2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何可逆反应都有一定的限度 | |
| B. | 反应条件改变,化学反应限度可能改变 | |
| C. | 化学反应达到平衡时,正、逆反应速率一定相等 | |
| D. | 化学反应达到平衡时,所有物质的微粒均不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向石蕊溶液中滴加氯水至足量 | 石蕊溶液先变红再褪色 | Cl2有酸性和漂白性 |
| B | 向大豆油、煤油中分别加入足量NaOH溶液,充分加热 | 一种液体仍然分层,另一种液体不再分层 | 分层者为煤油,不分层者为大豆油 |
| C | 向某溶液中加入足量盐酸 | 生成白色沉淀 | 该溶液中含有Ag+ |
| D | 用容量瓶配制一定物质的量浓度的K2SO4溶液,定容后反复摇匀 | 液面低于刻度线 | 所配溶液浓度偏高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
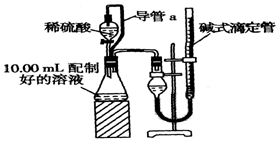 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0溶于水中,配成250mL溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com