
| X | 与Al同周期,金属性最强 |
| Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
| Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
| W | 单质紫黑色,遇淀粉溶液显蓝色 |
 ;W在元素周期表中的位置是第五周期第ⅦA族;
;W在元素周期表中的位置是第五周期第ⅦA族;分析 X与Al同周期,金属性最强,因为Na元素,Y与Al同周期,最外层电子数是最内层电子数的3倍,应为S元素,Z常温下单质为双原子分子,为黄绿色有毒气体,为Cl元素,W单质紫黑色,遇淀粉溶液显蓝色,为I元素,结合对应单质 Cl2+H2S=S+2H++2 Cl-或 Cl2+S2-=S+2 Cl-、化合物的性质以及元素周期率解答该题.
解答 解:(1)由以上分析可知X为钠元素,Y为S,原子核外有3个电子层,最外层电子数为6,原子结构示意图为 ,W为I,位于周期表第五周期第ⅦA族,
,W为I,位于周期表第五周期第ⅦA族,
故答案为:钠; ;第五周期第ⅦA族;
;第五周期第ⅦA族;
(2)X为Na,对应的最高价氧化物的水化物为NaOH,与铝反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)非金属性Cl>S,可根据单质之间的置换反应证明,元素的非金属性越强,对应的单质的氧化性越强,可发生 Cl2+H2S=S+2H++2 Cl-或 Cl2+S2-=S+2 Cl-,
故答案为:>; Cl2+H2S=S+2H++2 Cl-或 Cl2+S2-=S+2 Cl-.
点评 本题考查了位置结构与性质的关系,题目难度中等,根据题干信息正确推断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题侧重基础知识的考查,有利于培养学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
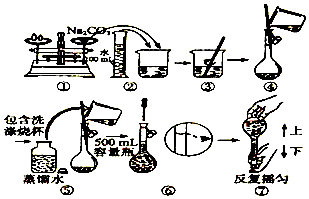
| A. | ②③ | B. | ④⑤ | C. | ①⑥ | D. | ①⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
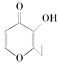 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还会致癌.“一滴香”的分了结构如右图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还会致癌.“一滴香”的分了结构如右图所示,下列说法正确的是( )| A. | 该有机物的分子式为C7H7O3 | |
| B. | 该有机物能发生取代、加成和氧化反应 | |
| C. | 1 mol该有机物最多能与2 mol H2发生加成反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与其他元素生成的化合物都是离子化合物 | |
| D. | b、c、d与氢形成的化合物中化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
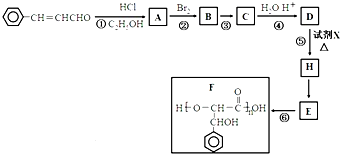 3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图:
3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图:
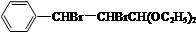 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$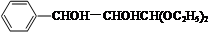 +2NaBr.
+2NaBr. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$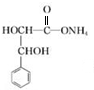 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. 或
或 . (任写一种)
. (任写一种) ,现以甲苯和乙醛为原料制备3-苯基丙烯醛
,现以甲苯和乙醛为原料制备3-苯基丙烯醛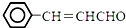 ,设计合成线路(其无机试剂任选),合成线路示意图示例如下:
,设计合成线路(其无机试剂任选),合成线路示意图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子数目为0.6NA | |
| C. | 标准状况下,2.24LCH3CH2OH含有共价键数为0.8NA | |
| D. | 12.5mL 16 mol•L-1浓硫酸与6.5g锌共热,转移的电子数等于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
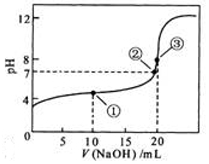 常温下,用 0.1000molL -1NaOH溶液滴定 20.00mL0.1000molL -1CH 3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000molL -1NaOH溶液滴定 20.00mL0.1000molL -1CH 3COOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 滴定过程中可能出现:c (CH 3COO -)>c (Na +)>c (CH 3COOH)>c (H +)>c (OH -) | |
| B. | 点①所示溶液中酸的中和率大于50% | |
| C. | 点②是二者恰好中和点 | |
| D. | 点③所示溶液中:c (Na +)>c (OH -)>c (CH 3COO -)>c (H +) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com