
【题目】(1)写出下列物质的电离方程式:① HCl=_____,② NaOH=___,③ NaCl =_______,④ H2SO![]() =____。
=____。
(2)选择下列实验方法分离物质,将分离方法的字母填在横线上。
A.萃取分液法 B.加热分解 C.结晶法 D.分液法 E.蒸馏法 F.过滤法
①________分离饱和食盐水和沙子的混合物;
②________从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
③________分离水和汽油的混合物;
④________分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)。
【答案】H++Cl- Na++OH- Na++Cl- 2H++SO42- F C D E
【解析】
(1) HCl是强电解质,在溶液中完全电离出氢离子和氯离子,电离方程式为:HCl=H++Cl-;NaOH是强电解质,在溶液中完全电离出氢氧根离子和钠离子,电离方程式为:NaOH=Na++OH-;NaCl是强电解质,在溶液中完全电离出钠离子和氯离子,电离方程式为:NaCl=Na++Cl-;H2SO![]() 是强电解质,在溶液中完全电离出氢离子和硫酸根离子,电离方程式为:H2SO4=2H++SO42-,故答案为: H++Cl-;Na++OH-;Na++Cl-;2H++SO42-;
是强电解质,在溶液中完全电离出氢离子和硫酸根离子,电离方程式为:H2SO4=2H++SO42-,故答案为: H++Cl-;Na++OH-;Na++Cl-;2H++SO42-;
(2)①沙子不溶于水,则选择过滤法分离饱和食盐水和沙子的混合物,故答案为:F;
②硝酸钾和氯化钠的溶解度受温度影响不同,则选择结晶法从硝酸钾和氯化钠的混合溶液中获得硝酸钾,故答案为:C;
③水和汽油不互溶,水和汽油的混合物分层,则选择分液法分离水和汽油的混合物,故答案为:D;
④四氯化碳和甲苯互溶,但沸点不同,则选择蒸馏法分离四氯化碳和甲苯,故答案为:E。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】用AG表示溶液酸度:![]() 。在室温下,用 0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
。在室温下,用 0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
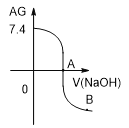
A. 0.1molL-1的CH3 COOH溶液的pH=3.4
B. A点加入的NaOH溶液的体积为20.00mL
C. 滴定过程中,c(CH3COO-)/c(H+)逐渐减小
D. B点溶液中可能存在c(Na+)>c(CH3COO-)> c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是实验室常用的部分仪器,请回答下列问题:
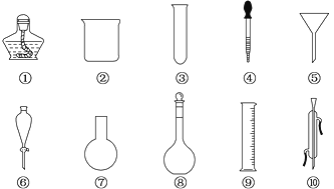
(1)序号为⑧和⑩的仪器的名称分别为________、________。
(2)在分液操作中,必须用到上述仪器中的________(填序号)。
(3)能作反应容器且可直接加热的仪器是上述中的________(填名称)。
(4)配制一定物质的量浓度的溶液时要用到的仪器是________(填序号)。
(5)仪器上标有温度的有________(填序号)。
(6)如图是温度计、量筒、滴定管的一部分,下述读数(虚线对应刻度)及说法正确的是________。
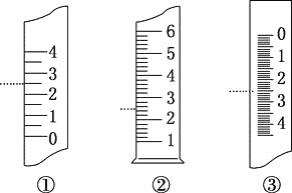
A.①是量筒,读数为2.5 mLB.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mLD.②是温度计,读数为2.5 ℃
(7)
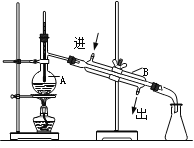
a.图中有两处明显的错误是:①________;②________。
b.A仪器的名称是________,B仪器的名称是________。
c.实验时A中除加入少量自来水外,还需要加入少量的________,其作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是
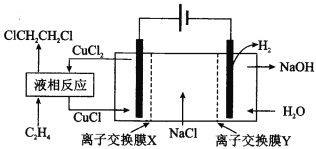
A. 该装置工作时,化学能转变为电能
B. CuCl2能将C2H4还原为 l , 2-二氯乙烷
C. X、Y依次为阳离子交换膜、阴离子交换膜
D. 该装置总反应为CH2CH2 + 2H2O + 2NaCl![]() H2 + 2NaOH + ClCH2CH2Cl
H2 + 2NaOH + ClCH2CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体烧碱配制500mL0.1000mol/L的NaOH溶液。

(1)需称量___g烧碱,应放在_______(填仪器名称)中称量。
(2)配制过程中,不需要的仪器(填写代号)_______。
a、烧杯 b、量筒 c、玻璃棒 d、500mL容量瓶 e、漏斗 f、胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器是____。
(4)步骤B通常称为转移,步骤A通常称为________。
(5)将上述实验步骤A到F按实验过程先后次序排列_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,H2R的钠盐溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(ɑ)随溶液pH变化关系如图所示,下列叙述不正确的是
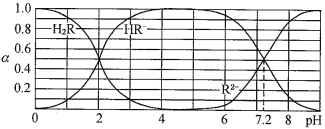
A. H2R属于二元弱酸
B. pH=8时,溶液中c(Na+)>c(R2-)>c(HR-)>c(OH-)>c(H+)
C. 若c(H2R)+2c(R2-)+c(OH-)=c(H+),则pH一定小于2
D. 配制c(R2-)=c(HR-)的钠盐溶液应控制溶液的pH=7.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A. 14g由N2与CO组成的混合气体含有的原子数目为![]()
B. 78g苯含有碳碳双键的数目为3![]()
C. 1L 1mol![]() 的NaClO溶液中含有ClO-的数目为
的NaClO溶液中含有ClO-的数目为![]()
D. 6.72L NO2与水充分反应转移的电子数目为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。电池工作时的总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,则下列说法正确的是
Li1-xFePO4+LixC6,则下列说法正确的是
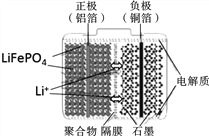
A. 图中聚合物隔膜是阴离子交换膜;
B. 充电时,Li+ 迁移方向是“由右向左”
C. 放电时,正极的电极反应式为LiFePO4—xe- = Li1-xFePO4 + xLi+
D. 用该电池电解精炼铜,当转移电子1.25mol时能得到精铜32g,则电子利用率为80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com