
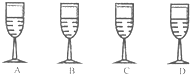
 在班级的“元旦晚会”中,小明表演魔术:在桌面上摆4个盛无色液体的高脚杯,他将A高脚杯液体分别倒入其他三个中,看到下列现象:B中液体产生大量气泡变为汽水;C中液体变为红色葡萄酒;D中液体变为“牛奶”(产生大量白色沉淀).
在班级的“元旦晚会”中,小明表演魔术:在桌面上摆4个盛无色液体的高脚杯,他将A高脚杯液体分别倒入其他三个中,看到下列现象:B中液体产生大量气泡变为汽水;C中液体变为红色葡萄酒;D中液体变为“牛奶”(产生大量白色沉淀).分析 A和B混合产生气体,说明为酸与碳酸盐的反应,A和C混合变红,说明为碱性物质与指示剂酚酞的反应,A与D混合变为牛奶,说明能产生白色沉淀.
解答 解:四杯溶液均为无色,A和B混合产生气体,说明为酸与碳酸盐的反应,A和C混合溶液变红,说明为碱性物质与酚酞的反应,从而可以看出A可能为碳酸钠,则B可能为盐酸,C可能为酚酞,A与D混合变为牛奶,说明能产生白色沉淀,则D可能为氢氧化钙,所以ABCD四种物质可能为:碳酸钠,盐酸,酚酞,氢氧化钙;
故答案为:碳酸钠,盐酸,酚酞,氯化钙.
点评 本题考查了常见物质的推断,解答时可以依据指示剂的变色、碳酸盐遇酸产生气体等知识进行解答,要求同学们在平时的学习中要注意知识的积累,以便灵活应用.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中所含的分子数为0.5NA | |
| B. | 标准状况下,22.4L O2与44.8L SO2充分反应后转移电子的数目为4NA | |
| C. | 各为0.1mol的H3O+和OH-中含有的电子数目均为0.9NA | |
| D. | 2.4g O2和O3的组成的混合气体中所含的氧原子数目为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的电离:H3PO4?3H++PO43- | |
| B. | 甲烷的燃烧为-890.3KJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| C. | 实验室制取氢氧化铁胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用双氧水处理含NaCN的碱性废水:2CN-+5H2O2+2OH-═2CO32-+N2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只有① | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 9:8 | C. | 3:4 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com