
【题目】无水AlCl3是一种重要的有机合成催化剂,该物质在183℃时升华,遇潮湿空气即产生大量白雾。某中学化学兴趣小组拟利用中学常见仪器设计实验制备无水AlCl3,实验装置如下图所示。请回答:
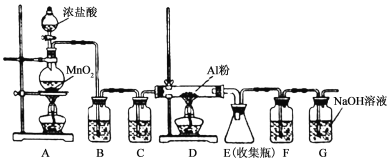
(1)制备实验开始时,先检查装置的气密性,接下来的操作依次是________。
a.加入MnO2粉末
b.点燃A中酒精灯
c.加入浓盐酸
d.点燃D处酒精灯
(2)写出A装置中发生反应的化学方程式___________________________________。
(3)装置B中的试剂是__________。该装置存在安全隐患,请指出 。
(4)装置F中试剂为 ,甲同学认为F和G可以用一种仪器替代,且加入一种药品即可达到相同效果。这种药品可以是 ,其作用是 。
【答案】(1)acbd;(2)MnO2+4HCl(浓)![]() MnCl2+Cl2 ↑+2H2O;(3)饱和食盐水;D、E间导管易发生堵塞;(4)浓硫酸,碱石灰;防止水蒸气进入E中,同时吸收多余的氯气。
MnCl2+Cl2 ↑+2H2O;(3)饱和食盐水;D、E间导管易发生堵塞;(4)浓硫酸,碱石灰;防止水蒸气进入E中,同时吸收多余的氯气。
【解析】
试题分析:(1)加入MnO2固体,浓盐酸受热易挥发,因此加入浓盐酸,加热b处的酒精灯,排除装置的中空气,然后点燃D处酒精灯,顺序是acbd;(2)装置A制取的是氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2 ↑+2H2O;(3)制备的氯气中含有HCl和水蒸气,需要把杂质除去,因此装置B的作用除去HCl,盛放的是饱和食盐水,装置C除去水蒸气,盛放的是浓硫酸,根据信息AlCl3易升华,因此D、E间导管易发生堵塞;(4)AlCl3遇潮湿空气产生白雾,防止G中的水蒸气进入E中,因此F中盛放的是浓硫酸,加一个盛放碱石灰的干燥管,防止水蒸气进入E中,同时吸收多余的氯气。
MnCl2+Cl2 ↑+2H2O;(3)制备的氯气中含有HCl和水蒸气,需要把杂质除去,因此装置B的作用除去HCl,盛放的是饱和食盐水,装置C除去水蒸气,盛放的是浓硫酸,根据信息AlCl3易升华,因此D、E间导管易发生堵塞;(4)AlCl3遇潮湿空气产生白雾,防止G中的水蒸气进入E中,因此F中盛放的是浓硫酸,加一个盛放碱石灰的干燥管,防止水蒸气进入E中,同时吸收多余的氯气。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
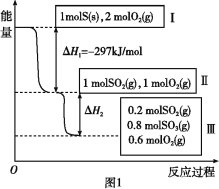
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。
已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)状态II到状态III放出的热量为 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为: 。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
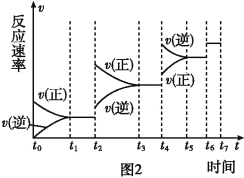
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅被誉为无机非金属材料的主角。有科学家提出硅是“21世纪的能源”“未来的石油”。下列有关说法正确的是( )
A.硅的含量居第二位,在地球上有丰富的单质硅资源,如石英、水晶的主要成分都是SiO2
B.单质硅是一种良好的半导体材料,可用于制造太阳能电池
C.存放NaOH溶液的试剂瓶应用玻璃塞
D.60gSiO2含有1NA 个SiO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的相对分子质量为102。
(1)经测定,该有机物含碳、氢、氧三种元素,其中含氢的质量分数为9.8%,分子中氢原子个数为氧原子的5倍。该有机物的分子式是________;若该有机物无甲基、无醚键,且能发生银镜反应,则该有机物的官能团的名称_______________,写出该有机物与新制的氢氧化铜的反应的化学方程式:________________________________________________。
(2)经红外光谱测定,该有机物分子中含有一个羧基、一个羟基和一个碳碳双键,则其可能的结构简式为_____________________________________________________(提示:羟基不能连在碳碳双键上)。
(3)经测定,该有机物只含碳、氢两种元素,且所有原子均在同一平面,请写出该有机物的结构简式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存的是( )
A.Ca2+、Mg2+、Cl-、NO3- B.Al3+、K+、SO42-、OH-
C.Fe2+、H+、SO42-、NO3- D.Na+、OH-、HCO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
键能/(kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子数之比为 ,化学式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2通过盛有水的洗气瓶,转移0.03mol电子时,参加反应的NO2气体在标准状况下的体积为
A. 224mL B. 336mL C. 448mL D. 672mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物CxHmOn完全燃烧时需要氧气的物质的量是该有机物的x倍,则其化学式中x、m、n的关系不可能的是 ( )
A.m︰n=2︰1 B.m=2x+2 C.x︰m︰n=1︰2︰1 D.m>2x+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为 (填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 ;
步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 | B.氢氧化钠溶液 | C.高锰酸钾溶液 | D.氨水 |
(3)检验步骤Ⅲ已经进行完全的试剂是 。
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为 。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式 ;
②测得该样品中Fe元素的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com