
| A. | C50、N70、C120、C540等互称为同素异形体 | |
| B. | CH3CH2CH2CH2OH的名称是:丁醇 | |
| C. | 2-戊烯的结构简式:CH3CH2CH=CHCH3 | |
| D. | 质子数为94、中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu. |
分析 A.由一种元素组成的不同单质互称为同素异形体,互为同素异形体的物质要符合以下两个条件:同种元素形成,不同单质;
B.多碳醇需标明官能团所在的位置;
C.2-戊烯即碳碳双键在2号碳和3号碳之间的戊烯;
D.元素符号的左上角表示的是质量数,Pu的质量数为238,左下角表示的是质子数为94;
解答 解:A.同素异形体是同种元素形成的不同单质,C50、C120、C540互称为同素异形体,但N70不是,故A错误;
B.CH3CH2CH2CH2OH的名称是:1-丁醇,故B错误;
C.主链为五个碳的烯,2-戊烯即碳碳双键在2号碳和3号碳之间的戊烯,2-戊烯的结构简式:CH3CH2CH=CHCH3,故C正确;
D.质子数为94、中子数为144的钚(Pu)原子,其质量数=质子数+中子数=94+144=238,质子数为94,左上角为238,左下角为94,故D错误;
故选C.
点评 本题考查了同素异形体、醇烯的命名等化学用语,题目难度不大,注意掌握常见的化学用语的表示方法,明确元素符号的左上角左下角数字的含义为高频考点.


科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,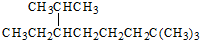 的名称为2,2,7-三甲基-6-乙基辛烷 的名称为2,2,7-三甲基-6-乙基辛烷 | |
| B. | 青蒿素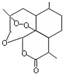 是抗恶性疟疾特效药,其分子式为C15H20O5 是抗恶性疟疾特效药,其分子式为C15H20O5 | |
| C. | 1mol达菲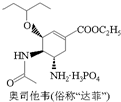 最多能与4molNaOH反应 最多能与4molNaOH反应 | |
| D. | CH3CH=CH-CH=CH2与溴的四氯化碳溶液发生加成反应最多可生成3种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
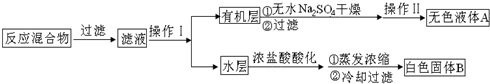
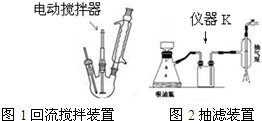
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2溶液:c(SO42-)>(K+)=c(Al3+ )>c(H+)>c(OH-) | |
| B. | NaHCO3溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | Na2S溶液:c(OH-)-(H+)=c(HS-)+c(H2S) | |
| D. | CH3COONa与 HCl混合后呈中性的溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
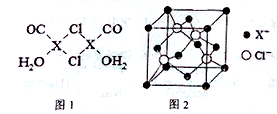 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.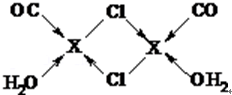 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | iPhone5外壳易掉色原因是,铝壳表面氧化处理过程中作为阳极的金属铝纯度不够 | |
| B. | 道尔顿、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 古代的陶瓷、砖瓦,现代的普通玻璃、水泥都是硅酸盐产品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com