


| ||
| △ |
| ||
| △ |
| ||


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| A、具有较高的熔点 |
| B、熔融状态能导电 |
| C、水溶液能导电 |
| D、常温下能溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
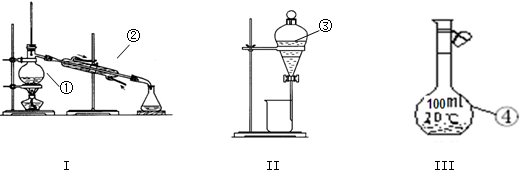
| A、为检验卤代烃中的卤原子,先加入NaOH溶液加热,再滴入AgNO3溶液观察颜色变化 |
| B、为检验醛基的存在,先向试管中加入2mL 2%的NaOH溶液和数滴CuSO4溶液,再加乙醛,煮沸 |
| C、为制取乙酸乙酯,将稀H2SO4和乙醇、乙酸混合加热,放出的蒸气通入盛有Na2CO3溶液的试管中 |
| D、为制取乙烯,将稀H2SO4和乙醇混合加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶胞是晶体结构中的基本结构单元 |
| B、晶体的外观规则,但是有些内部结构是无序的 |
| C、晶体是晶胞的堆积 |
| D、晶胞都是正八面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40 g NaOH溶解于1 L水中 |
| B、将22.4 L HCl气体溶解于水配成1 L溶液 |
| C、将1 L 5 mol/L的盐酸加水稀释至5L |
| D、将10 g NaOH配制成 250 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 铬及其化合物在工业上用重要用途,请回答下列问题:
铬及其化合物在工业上用重要用途,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.查看答案和解析>>
科目:高中化学 来源: 题型:

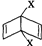 和
和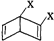 之外,还有多种同分异构体,
之外,还有多种同分异构体,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com