
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10。下列说法不正确的是
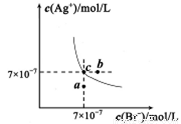
A.在t℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:选择题
下列有关溶度积常数Ksp的说法正确的是
A.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小
B.溶度积常数Ksp只受温度影响,温度升高Ksp减小
C.溶度积常数Ksp只受温度影响,温度升高Ksp增大
D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:填空题
【有机物化学基础】
肉桂酸甲酯( )又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
)又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
(1)有关肉桂酸甲酯的叙述中,正确的是 (填标号)。
A.肉桂酸甲酯的摩尔质量为163g/mol B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应 D.能发生加聚反应生成高分子化合物
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。G的结构简式为 。

(3)用芳香烃A为原料合成G的路线如下:
①化合物E中的官能团有 (填名称)。

②B→C该反应的化学方程式为 。
③A→B、E→F的反应类型是 、 。
④符合下列条件的F的同分异构体的结构简式是 。
a.分子内含苯环,且苯环上只有一个支链;
b.在一定条件下,l mol该物质与足量银氨溶液充分反应,生成4mol银单质。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:简答题
【化学与技术】
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。

(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料。
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为 。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)检验过滤Ⅰ所得滤液中含有CO32-的方法是 。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是 。
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(6)上述工艺流程中体现绿色化学理念的是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32—、SO32—、SO42—、C1—、NO2-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:

下列结论正确的是
A X中肯定存在Na+、Fe2+、A13+、NH4+、SO42—
B气体F经催化氧化可直接生成气体D
C沉淀C一定是BaSO4、 沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D X中不能确定的离子是 A13+、Na+、K+和C1—
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A、B与C;D、E与F分别位于同一周期。A原子L层上有3个未成对电子,B的简单负二价离子与C原子核外电子排布相同、含有D元素的盐的焰色反应火焰为黄色,EF3是由活泼金属和活泼非金属组成的共价化合物,G有多种氧化物,其中一种氧化物有磁性,填写下列空白
(1)元素的第一电离能最大的是________, 属于过渡元素的是________(填写元素符号)
(2)写出B元素的基态原子价电子排布式__________________,F离子电子排布式_________________。
(3)AF3分子中A原子的杂化类型是________,AF3分子的几何构型为___________。
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:________________________________________________________。
(5)构成G晶体的微粒是________,G的晶胞结构如下图甲所示,G的晶胞为________结构。若G原子的半径为1.27×10-10 m,G金属晶体中的晶胞长度,即下图乙中AB的长度为________m。
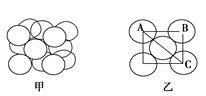
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
下列说法正确的是
A.油脂饱和程度越大,熔点越低
B.氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应
C.蔗糖、硬脂酸甘油酯酸性水解都能得到2种物质
D.麻黄碱( )的催化氧化产物能发生银镜反应
)的催化氧化产物能发生银镜反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:简答题
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mo l。
l。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。
 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为
 (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:

① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如右图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:简答题
有机物G(分子式为 C13H18O2)是一种香料,其合成路线如下图所示。其中A是一种相对分子质量为70的烃,核磁共振氢谱有四个峰且峰面积之比为6:2:1:1;B是一种芳香族含氧衍生物,相对分子质量在100-130之间,B中含氧元素的质量分数为13.1%,F可以使溴的四氯化碳溶液褪色。
已知: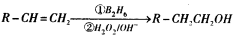
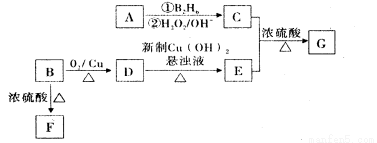
请回答下面的问题:
(1)化合物A的结构简式为____,按系统命名法命名的名称是____。
(2)化合物B的分子式为____,B在上图转化中发生??反应所属的反应类型是____。
(3)写出D→E反应的化学方程式____。
(4)写出C与E生成G反应的化学方程式____。
(5)E的同分异构体有多种,写出符合下列条件的所有物质的结构简式____。
a.属于芳香族化合物且苯环上的一氯代物有两种;b.含有“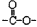 ”基团
”基团
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com