
(14分)铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
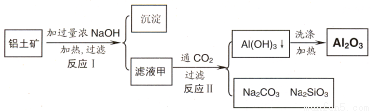
(1)滤液甲的主要成分是(写化学式)
(2)写出反应 II 的离子方程式:
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是 (填字母序号)
A.AlO2― B.OH― C.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为:
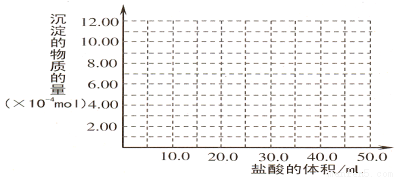
(5)取 (4) 电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol? L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。
①加入50.0mL 盐酸溶液发生的离子反应的先后顺序依次为:
②请画出生成沉淀的物质的量与加入盐酸体积的关系图。
⑴ NaOH、NaAlO2、Na2SiO3
⑵ CO2+2OH-==CO32-+2H2O CO2+2H2O +2 AlO2-==2Al(OH)3↓+HCO3-
⑶ b>a>c ⑷ Al(OH)3 +OH-=AlO2-+2H2O
⑸ ① H++OH-==H2O AlO2-+H++H2O =Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O
②图像如下所表示。

【解析】
试题分析:(1)铝土矿中加入过量的NaOH溶液,其中的Al2O3、SiO2发生反应得到NaAlO2、Na2SiO3和过量的NaOH溶液,所以滤液甲的主要成分是NaAlO2、Na2SiO3、NaOH;不溶性的固体是 Fe2O3。(2)向含有NaAlO2、Na2SiO3、NaOH的溶液中通入过量CO2,发生反应CO2+2OH-=CO32-+2H2O ;CO2+2H2O +2AlO2-==2Al(OH)3↓+HCO3-,得到Al(OH)3沉淀。(3)H2O是中性物质;Al(OH)3是两性物质,H2SiO3是弱酸。所以微粒结合质子 ( H+) 的能力,由强到弱的顺序是b>a>c。(4)向含有NaAlO2、Na2SiO3、NaOH的加入过量盐酸发生反应得到AlCl3、NaCl、H2SiO3;溶液为AlCl3、NaCl的混合溶液。用惰性电极电解,在阴极发生反应:2H++2e-=H2↑,由于破坏了附近的水的电离平衡,溶液中OH-的浓度增大,OH-与溶液中的Al3+发生反应形成Al(OH)3沉淀。在阳极发生反应:2Cl-—2e-=Cl2↑。当溶液呈碱性时,又发生反应:Al(OH)3+ OH-= AlO2-+ 2H2O。沉淀又逐渐溶解而消失。(5)①加入50.0mL 盐酸溶液发生的离子反应的先后顺序是H++OH-=H2O ;AlO2-+H++H2O =Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O 。 由于二者的物质的量相等,所以它们都是是0.100 mol/L×0.01L=0.001mol。NaOH与HCl反应消耗10mlHCl; NaAlO2与HCl反应形成Al(OH)3沉淀消耗10mlHCl;溶解Al(OH)3沉淀消耗30mlHCl.图像见图示:
考点:考查元素与化合物的性质、混合物的分离、离子方程式的书写、n(HCl)与沉淀的关系图像的知识。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源:2013-2014黑龙江省双鸭山市高二下学期期末考试化学试卷(解析版) 题型:实验题
(16)某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
(1)测定硝酸的物质的量反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如右上图所示。在B容器中生成硝酸的物质的量为 mol。
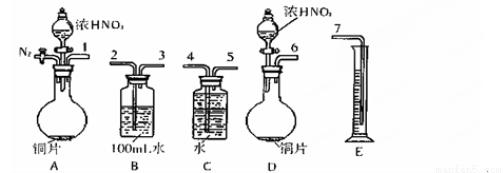
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Cu与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来完成实验并测定生成NO体积的装置,其合理的连接顺序是(填各导管口编号) 。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置 (“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析:若实验测得NO的体积为112.0mL(已折算到标准状况),则Cu与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是 。
(4)实验前,用托盘天平称取的铜片至少应为 g。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省双鸭山市高一下学期期末考试化学试卷(解析版) 题型:选择题
100 mL 6 mol·L-1的H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①Na2CO3溶液 ②水 ③K2SO4溶液 ④KNO3溶液
A.①③B.②③C.①④D.②④
查看答案和解析>>
科目:高中化学 来源:2013-2014青海西宁五中片区大联考高三5月高考模拟理综化学试卷(解析版) 题型:实验题
(14分)黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:

用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准碘溶液20.00mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是 ;标准碘溶液应盛放在(填“碱式”或“酸式”) 滴定管中。
(2)装置a的作用是
(填序号)。
A.除去空气中的二氧化碳 B.除去空气中的水蒸气
C.有利于气体混合 D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果(填“偏低”、“偏高”或“无影响”) ,写出影响测定结果的化学方程式: 。
(4)上述反应结束后,仍需通一段时间的空气,其目的是 。
(5)通过计算可知,该黄铜矿的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014青海西宁五中片区大联考高三5月高考模拟理综化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.乙烯分子的电子式 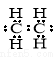
B.硫原子的结构示意图 
C.淀粉的化学式 (C6H10O5)n
D.硫酸铁的电离方程式 Fe2(SO4)3 = 2Fe2+ + 3SO42ˉ
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三四月月考化学试卷(解析版) 题型:选择题
下列关于有机物的说法中正确的是( )
A.油脂属于高分子化合物
B.含五个碳原子的有机物,分子中最多可形成四个碳碳单键
C.分子式为C8H6O2的芳香族有机物分子中不可能有羧基
D.汽油、煤油和植物油都是碳氢化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三五月月考化学试卷(解析版) 题型:填空题
(14)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示:
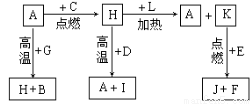
请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;该反应的化学方程式为 ___________________。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式_________________
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三五月月考化学试卷(解析版) 题型:选择题
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+ 。下列叙述不正确的是
A.氧化产物为Cl2
B.氧化剂与还原剂的物质的量之比为1∶2
C.若有3mol H2O生成,则反应中有2mol电子转移
D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省延安市第一学期期末考试高二化学试卷(解析版) 题型:选择题
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是
A. 电解时以精铜作阳极
B.电解时阴极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu =Cu2+ + 2e-
D.电解结束,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com