
| A.微粒半径:S>S2->Cl->F |
| B.酸性:HClO4>H2SO4>H3PO4 |
| C.氧化性:Cl2>S>Se>Te |
| D.离子还原性:S2->I->Br->OH- |


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:不详 题型:单选题
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| C.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.A原子得到电子的数目比B原子少 |
| B.A元素的最高正价比B元素的最高正价要高 |
| C.气态氢化物的稳定性:A比B强 |
| D.A单质能与B的氢化物水溶液反应,生成B单质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:W>Z>Y>X |
| B.气态氢化物的稳定性:Y>Z |
| C.最高价氧化物对应水化物的酸性:W>Z |
| D.四种元素的单质中,Z的熔沸点最高 |
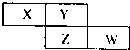
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.常温时硫是固体,而氯气为气体 |
| B.向H2S的水溶液中通入Cl2可得到淡黄色的固体S |
| C.Cl2与Fe反应生成FeCl3,S与Fe共热生成FeS |
| D.与金属镁反应时,氯原子得到1个电子,而硫原子得到2个电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素M与氢元素组成化合物一定是正四面体型分子 |
| B.X、Y两种元素的气态氢化物均能与它们对应的最高价氧化物的水化物发生反应,且反应类型相同 |
| C.X、Z两种元素的氢化物相互反应的产物是共价化合物 |
| D.四种元素形成的气态氢化物中,Z元素形成的氢化物热稳定性最大 |
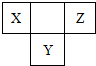
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
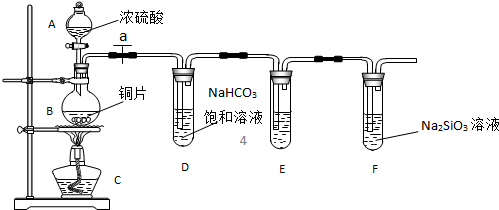
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com