
 如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )| A. | 肯定是NO2气体 | B. | 肯定是O2与NO2的混合气体 | ||
| C. | 肯定是NO与O2的混合气体 | D. | 可能是NO与NO2的混合气体 |
分析 试管中盛装的是红棕色气体,一定含NO2,O2与NO2的混和气体可在溶液中发生反应4NO2+O2+2H2O=4HNO3,O2与NO的混和气体可在溶液中发生反应4NO+3O2+2H2O=4HNO3,试管内能完全被水充满,以此来解答.
解答 解:若只有NO2,发生3NO2+H2O=2HNO3+NO,则试管中液面上升,但不能充满试管,
NO与NO2的混和气体,当向试管内鼓入氧气后,可在溶液中发生反应4NO+3O2+2H2O=4HNO3,4NO2+O2+2H2O=4HNO3,试管内能完全被水充满,
则A、B、D均可能,C在NO与氧气化合生成二氧化氮,C中可能符合,
故选D.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 断开一个N≡N,同时有六个N-H键生成 | |
| B. | 生成氨的速率与分解氨的速率相等 | |
| C. | N2、H2,、NH3的质量分数不再变化 | |
| D. | 混合气体总压不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00- | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7的降水成为酸雨 | |
| B. | 硅酸钠可用于制备木材防火剂 | |
| C. | 水泥、陶瓷、玻璃都属于硅酸盐产品 | |
| D. | 冬季大量使用燃煤取暖会导致雾霾的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
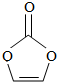
| A. | 分子式为C3H2O3 | B. | 分子中只含有极性键 | ||
| C. | 分子中含6个σ键 | D. | 各碳原子杂化的方式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
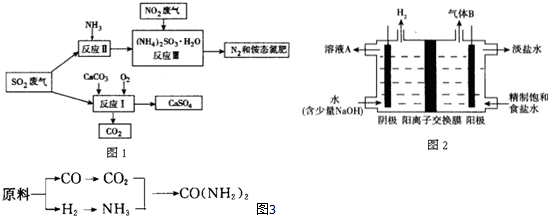
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
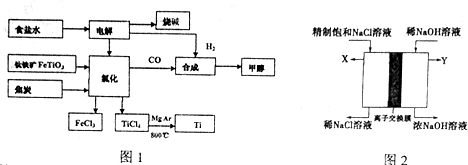
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com