
����Ŀ���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��N2(g)+3H2(g)![]() 2NH3(g) H����92.2 kJ��mol��1 ���ݴ˻ش��������⣺
2NH3(g) H����92.2 kJ��mol��1 ���ݴ˻ش��������⣺
��1����ij�¶��£����� 10 mol N2 �� 30 mol H2�������Ϊ 10 L ���ܱ������ڣ���Ӧ�ﵽƽ��״̬ʱ����û�������а����������Ϊ 20��������¶��·�Ӧ��K=_______ (���÷�����ʾ)��
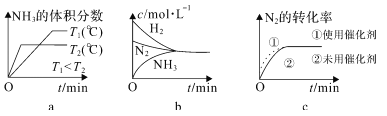
�ڶ��ںϳɰ���Ӧ���ԣ������й�ͼ��һ����ȷ����______��ѡ����ţ���
���ڼ�����Һ��ͨ����ⷨ����ʵ���� N2 ��ȡ NH3��2N2+6H2O![]() 4NH3+3O2�������ĵ缫��Ӧʽ��_______________��
4NH3+3O2�������ĵ缫��Ӧʽ��_______________��
��2�������£����� 0.1 mol��L��1 ������� 20 mL 0.1 mol��L��1 ��ˮ�У���Һ pH �������������ı仯��������ͼ��ʾ��
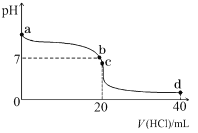
��NH3��H2O �ĵ��뷽��ʽ��_______________��
��b ����ʾ��Һ�е�������_______________��
��c ����ʾ��Һ�У�����Ũ�ȴӴ�С�Ĺ�ϵΪ_______________��
�ܳ����£����� amol/LNH3��H2O �������� bmol/L �������ϣ���ַ�Ӧ����Һ������(�����ǰ�ˮ������Ļӷ�)������¶��� NH3��H2O �ĵ��볣��Ka=___________���ú� a �� b �Ĵ���ʽ��ʾ��
���𰸡� 1/12 ac N2+6e-+6H2O= 2NH3+6OH- NH3��H2O![]() NH4+��OH�C NH4Cl��NH3��H2O c(Cl�C) ��c (NH4+)��c (H+)��c (OH�C) 10-7b/(a-b)
NH4+��OH�C NH4Cl��NH3��H2O c(Cl�C) ��c (NH4+)��c (H+)��c (OH�C) 10-7b/(a-b)
����������1���� N2��g��+3H2��g��2NH3��g��
��ʼŨ�ȣ�mol/L�� 1 3 0
ת��Ũ�ȣ�mol/L�� x 3x 2x
ƽ��Ũ�ȣ�mol/L��1-x 3-3x 2x
ƽ���������а������������Ϊ20%����![]() ��100%=20%�����x=
��100%=20%�����x=![]() ��ƽ�ⳣ��K=
��ƽ�ⳣ��K=![]() =
=![]() ����a���ȳ��ֹյ���ȴﵽƽ�⣬��T2���¶ȸߣ�ƽ�������ƶ�����ͼ��һ�£�ѡ��a��ȷ��b��ƽ��ʱŨ�Ȳ�һ����ȣ�ƽ��Ũ��ȡ����ʼŨ�Ⱥ�ת���ʣ�ͼ���ʾ����ѡ��b����c��ʹ�ô����ӿ췴Ӧ���ʣ���ƽ����Ӱ�죬ƽ��ʱ���ʵ�Ũ�Ȳ��䣬��ͼ��һ�£�ѡ��c��ȷ����ѡac��������N2�õ����ӣ����ϼ����ߣ�������ԭ��Ӧ������OH-ʧȥ���ӷ���������Ӧ��������Ӧ��N2+6e-+6H2O=2NH3+6OH-����2����һˮ�ϰ���������ʣ���ˮ��Һ��ֻ�в��ֵ��룬��������������Ӻ�笠����ӣ�һˮ�ϰ��ĵ��뷽��ʽΪ��NH3��H2O
����a���ȳ��ֹյ���ȴﵽƽ�⣬��T2���¶ȸߣ�ƽ�������ƶ�����ͼ��һ�£�ѡ��a��ȷ��b��ƽ��ʱŨ�Ȳ�һ����ȣ�ƽ��Ũ��ȡ����ʼŨ�Ⱥ�ת���ʣ�ͼ���ʾ����ѡ��b����c��ʹ�ô����ӿ췴Ӧ���ʣ���ƽ����Ӱ�죬ƽ��ʱ���ʵ�Ũ�Ȳ��䣬��ͼ��һ�£�ѡ��c��ȷ����ѡac��������N2�õ����ӣ����ϼ����ߣ�������ԭ��Ӧ������OH-ʧȥ���ӷ���������Ӧ��������Ӧ��N2+6e-+6H2O=2NH3+6OH-����2����һˮ�ϰ���������ʣ���ˮ��Һ��ֻ�в��ֵ��룬��������������Ӻ�笠����ӣ�һˮ�ϰ��ĵ��뷽��ʽΪ��NH3��H2O![]() NH4+��OH�C����b����Һ�����ԣ���c��H+��=c��OH-�����Ȼ����ǿ�������Σ���ˮ��Һ�����ԣ�Ҫʹ��ˮ��Һ�����ԣ���ˮӦ����������������ΪNH4Cl��NH3��H2O����c����Һ�����ԣ�c ��H+����c ��OH-��������Һ�ĵ���غ�c��Cl-��+c��OH-��=c��NH4+��+c��H+����֪c ��Cl-����c ��NH4+������Һ������Ϊ笠�����ˮ��£���Ũ�ȴ�С˳��Ϊc ��Cl-����c ��NH4+����c ��H+����c ��OH-��������a molL-1�İ�ˮ��b molL-1������������ϣ���Ӧ����Һ�����ԣ���Һ��c��OH-��=1��10-7mol/L��
NH4+��OH�C����b����Һ�����ԣ���c��H+��=c��OH-�����Ȼ����ǿ�������Σ���ˮ��Һ�����ԣ�Ҫʹ��ˮ��Һ�����ԣ���ˮӦ����������������ΪNH4Cl��NH3��H2O����c����Һ�����ԣ�c ��H+����c ��OH-��������Һ�ĵ���غ�c��Cl-��+c��OH-��=c��NH4+��+c��H+����֪c ��Cl-����c ��NH4+������Һ������Ϊ笠�����ˮ��£���Ũ�ȴ�С˳��Ϊc ��Cl-����c ��NH4+����c ��H+����c ��OH-��������a molL-1�İ�ˮ��b molL-1������������ϣ���Ӧ����Һ�����ԣ���Һ��c��OH-��=1��10-7mol/L��
��Һ��c��NH4+��=c��Cl-��=![]() mol/L����Ϻ�Ӧǰc��NH3H2O��=
mol/L����Ϻ�Ӧǰc��NH3H2O��=![]() mol/L����Ӧ��c��NH3H2O��=��
mol/L����Ӧ��c��NH3H2O��=��![]() -
-![]() ��mol/L��Kb=
��mol/L��Kb= =
=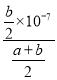 =10-7
=10-7![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧһѡ��3:���ʽṹ������](15 ��)
����ԭ�ӷ�Ӧ�ѵ�ԭ�ϣ������˵Ļ�������UF4��UO2��(NH4)4[UO2(CO3)3�ȡ�
�ش���������:
(1) UF4��Mg��Ca ��ԭ�ɵý����ˡ���̬��ԭ�ӵĺ�������Ų�ʽΪ__________________���۵㣺MgO(2852��)����CaO(2614��)��ԭ����_______________________________�������˵�һ�ֶѻ���ʽΪ���������ѻ�,�öѻ���ʽ�Ŀռ�������Ϊ_______________________________��
(2)��֪:2UO2+5NH4HF2 ![]() 2UF4��NH4F+3NH3��+ 4H2O����NH4HF2�к��е���������________(��ѡ����ĸ)��
2UF4��NH4F+3NH3��+ 4H2O����NH4HF2�к��е���������________(��ѡ����ĸ)��
a.��� b.��λ�� c.���ۼ� d.���Ӽ� e.������
(3)��֪:3[(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3 ��+9CO2 ��+N2 ��+9H2O��
3UO2+10NH3 ��+9CO2 ��+N2 ��+9H2O��
��NH4+�Ŀռ乹��Ϊ_____________________����NH4+��Ϊ�ȵ�����ķ��ӻ�������_____(��д����)��
��CO32-��̼ԭ�ӵ��ӻ��������Ϊ___________________________��
���ֽ���������ڷǼ��Է��ӵ���____________________(��ѡ����ĸ)��
a.NH3 b. CO2 C.N2 d. H2O
(4)UO2�ľ����ṹ������������ͼ��ʾ:
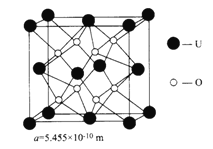
��������U ����λ��Ϊ__________________________��
��UO2������ܶ�Ϊ_____________g��cm-3(�г�����ʽ���ɡ���NA��ʾ�����ӵ�������ֵ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������a.BaCl2 b.���ʯ c.NH4Cl d.Na2SO4 e.�ɱ� f.��Ƭ�������ʣ�������Ҫ��ش����ж��ѡ��ģ���ѡ��ѡ�����֣���
���ۻ�ʱ��Ҫ�ƻ����ۼ�����______�� �۵���ߵ���_______���۵���͵���_______��
���������ӻ��������________��ֻ�������Ӽ���������________���������ֻ�ѧ����������_________�����з��Ӽ�����������__________��
��2������ͼ�ش���������
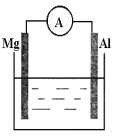
�����ձ�����ҺΪϡ���ᣬ��۲쵽��������___________��������ӦʽΪ___________��
�����ձ�����ҺΪ����������Һ����Ϊ_______����Mg��Al�����ܷ�Ӧ����ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ȡpH=2�����ֶ�Ԫ��H2A��H2B��1mL���ֱ��ˮϡ�ͣ����pH�仯���ˮϡ�ͱ�������ͼ��ʾ�仯���������й�������ȷ���ǣ� ��
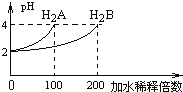
A. H2AΪ��Ԫ���ᣬϡ��ǰc(H2A)=0.005mol/L
B. NaHAˮ��Һ�У�c(Na+)+ c(H+)= 2c(A2-)+ c(OH-)
C. �������ʵ�����NaHA��NaHB�Ļ����Һ�У�c(Na+)= c(A2-)+ c(B2-)+ c(HB-)+ c(H2B)
D. pH=10��NaHB��Һ�У�����Ũ�ȴ�СΪ��c(Na+)��c(HB-)��c(OH-)��c(B2-)��c(H2B)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ֳ�����ʳƷ���Ӽ���������ͼʵ��ɼ���ijʳƷ���������κ����������Լ���������������˵������ȷ����

A������������ΪʳƷ���Ӽ��������Ƿ�������
B����Ӧ�ٹ�����ͨ��N2�������ǽ�װ���п��������ɵ�����ȫ���ϳ�
C���ⶨ��Ʒ���������кļ������ɲⶨ��Ʒ���������κ���
D�����������е���������H2O2��Һ���滻Ϊ��ˮ���Բⶨ�����Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2CO(g)+O2(g)=2CO2(g) ��H=-566 kJ��mol-1
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) ��H=-452 kJ��mol-1
���������Ȼ�ѧ����ʽ�жϣ�����˵����ȷ����
A. 1molCO ��ȫȼ�գ��ų�����Ϊ283 J
B. Na2O2(s)+CO2(s)=Na2CO3(s)+ ![]() O2(g) ��H=-226 kJ��mol-l
O2(g) ��H=-226 kJ��mol-l
C. CO(g) ��Na2O2(s)��Ӧ�ų�509kJ ����ʱ������ת����Ϊ1.204��1024
D. CO ��ȼ����Ϊ566 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.����Ӧ����㷺�Ľ���������±����Ȼ����Լ������ĺ������ξ�Ϊ��Ҫ�������֪��������һ����Ҫ�Ļ���ԭ�ϣ���ˮ�Ȼ�������ʪ����������ˮ����FeCl3��nH2O��
(1)ijѧϰС������ͼװ����ʵ�����Ʊ���ˮ�Ȼ���������һ������С��Ļ��
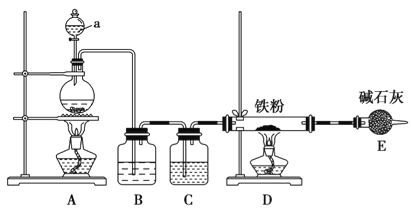
��װ��A�з��������ӷ���ʽ_______________
��װ��B��������________��C�е��Լ�______________��
��ʵ�鿪ʼʱ�ȵ�ȼ___���ƾ��ƣ�װ��E������Ϊ__________��
(2)��ҵ���Ʊ���ˮ�Ȼ�����һ�ֹ�����������:
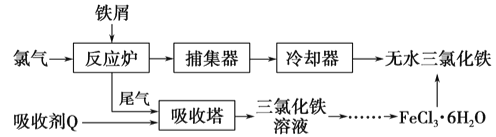
���������з�����Ӧ�����ӷ���ʽΪ__________
�ڼ�����FeCl3��6H2O����õ���ˮ�Ȼ����IJ���:____________
��.������ͼ��ʾ��װ�ã�������֤NH3��HCl���й����ʡ�ʵ��ǰa��b��c�������رա�
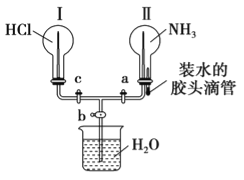
(1)��Ҫ����ƿ���в�������Ȫ��������ƿ���в���������Ȫ�����������������______��
(2)���ȴ�a��c�������ټ�ѹ��ͷ�ι�(����NH3���ܱ���ȫ����),����ƿ���пɹ۲쵽��������_____��
(3)ͨ����ѹ��ͷ�ιܺͿ��ƻ����Ŀ��أ�Ҫ����ƿ���в�������Ȫ��������ƿ���в���������Ȫ�����������������___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǰ�(NH2OH )ΪһԪ����(25��ʱ����߳���Kb=9.0��10-9)������뷽��ʽΪNH2OH+H2O ![]() NH3OH++OH-�� 25��ʱ����0.100mol�� L-1����ζ�20mL0.100mol�� L-1NH2OH��Һ���ζ�������ˮ���������H+Ũ�ȵĸ���������������Ĺ�ϵ��ͼ��ʾ(��֪��lg3=0.5) ������˵������ȷ������ ��
NH3OH++OH-�� 25��ʱ����0.100mol�� L-1����ζ�20mL0.100mol�� L-1NH2OH��Һ���ζ�������ˮ���������H+Ũ�ȵĸ���������������Ĺ�ϵ��ͼ��ʾ(��֪��lg3=0.5) ������˵������ȷ������ ��
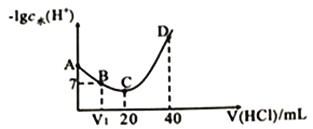
A. V1<10
B. A���Ӧ��Һ��pH=9.5
C. A ��B��C ��D�ĵ��Ӧ����Һ��NH2OH���볣�����
D. D���Ӧ��Һ�д��ڣ�c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��̬����������ܶȸߡ��ɱ��ͣ��乤.��ԭ����ͼ��ʾ�����е缫a���ò���ʯīϩ��S8���ϣ���ط�ӦʽΪ16Li+xS8=8Li2Sx(2��x��8)��ͬʱ���ô�װ�õĵ��������϶�ͭ������˵������ȷ����
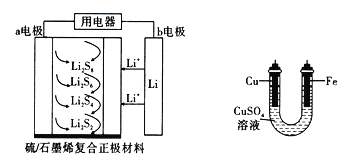
A. ��ع���ʱ��a�����������·������0.02mol���ӣ��������ϼ���0.14g
B. ʯīϩ��������Ҫ����ߵ缫a�ĵ�����
C. �������ص缫�ṩ1mol����ʱ�������������缫����32g
D. �ŵ�ʱ��Li+�������ƶ����ڴ˵���м�����������ӵ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com