
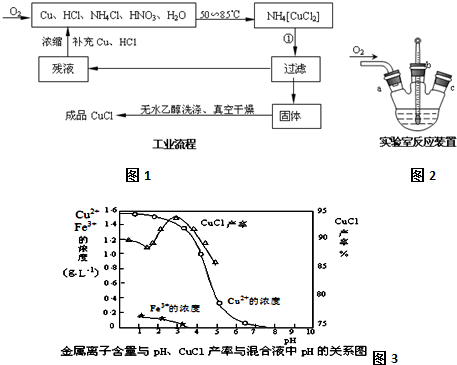
分析 (1)依据流程分析NH4[CuCl2]分解产物过滤后得到滤液为氯化铵,固体为CuCl;
(2)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化;
(3)依据乙醇沸点低利用蒸馏方法回收利用,制备过程中的氯化铵和硝酸直接利用;
(4)制备氯化亚铜所用的原料中含有氯化铵溶解过程中吸热,生成的红棕色气体二氧化氮污染气体不能排放,需要通入氧气至恰好吸收生成硝酸循环使用;
(5)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl;由图可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少.
解答 解:(1)NH4[CuCl2]分解产物过滤后得到滤液为氯化铵,固体为CuCl,反应的化学方程式为NH4[CuCl2]=CuCl↓+NH4Cl,
故答案为:NH4[CuCl2]=CuCl↓+NH4Cl;
(2)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化;
(3)根据乙醇的沸点较低,可以利用蒸馏的方法回收乙醇循环利用,反应过程中的氯化铵和硝酸可以在混合液中 直接利用,
故答案为:蒸馏;HNO3;
(4)制备氯化亚铜所用的原料为Cu、HCl、NH4Cl、HNO3、H2O,其中含有氯化铵溶解过程中吸热,反应过程中生成的红棕色气体二氧化氮污染气体不能排放,需要通入氧气至恰好吸收生成硝酸循环使用,4NO2+O2+2H2O=4HNO3,
故答案为:氯化铵溶于水吸收大量热量,造成反应液温度降低;烧瓶上方红棕色气体逐渐变为无色;
(5)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;由图可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右,故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;3.
点评 本题考查了物质制备的流程分析和反应产物判断,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握反应条件、反映实际的选择,反应过程中物质循环利用的绿色化学思想,题目难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg2+、K+、Cl-、AlO2- | B. | Al3+、Na+、NO3-、HCO3- | ||
| C. | NH4+、Fe3+、SO42-、NO3- | D. | Ca2+、H+、NO3-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高CO2充气压力,饮料中c(A-)不变 | |
| B. | 当pH为5.0时,饮料中 $\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| C. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| D. | 结合H+的能力:A->HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com