
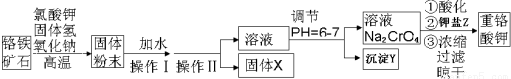
分析 由制备流程可知,高温下发生6FeO•Cr2O2+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7HCl+12H2O,固体加水,Fe2O3不溶于水,SiO2、Al2O3与NaOH反应而溶解,则操作I为溶解,操作Ⅱ为过滤,固体X为Fe2O3,溶液中含硅酸根离子、偏铝酸根离子,调节pH均转化为沉淀,Na2CrO4溶液在酸性溶液中反应生成K2Cr2O7,浓缩、结晶、过滤、干燥得到K2Cr2O7固体,以此来解答.
解答 解:由制备流程可知,高温下发生6FeO•Cr2O2+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7HCl+12H2O,固体加水,Fe2O3不溶于水,SiO2、Al2O3与NaOH反应而溶解,则操作I为溶解,操作Ⅱ为过滤,固体X为Fe2O3,溶液中含硅酸根离子、偏铝酸根离子,调节pH均转化为沉淀,Na2CrO4溶液在酸性溶液中反应生成K2Cr2O7,浓缩、结晶、过滤、干燥得到K2Cr2O7固体,
(1)FeO•Cr2O3与氯酸钾、氢氧化钠高温反应方程式为6FeO•Cr2O2+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O,反应中每7mol氯酸钾参加反应转移42mol电子,所以若有245g 即2molKClO3 参加反应,则转移的电子数为12mol,
故答案为:6FeO•Cr2O2+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O;12mol;
(2)由上述分析可知,操作Ⅱ分离溶液与不溶性固体,名称为过滤,根据上面的分析可知,固体X为Fe2O3,溶液中含硅酸根离子、偏铝酸根离子,调节pH均转化为沉淀,则Y中含Al(OH)3、H2SiO3,
故答案为:过滤;Fe2O3;Al(OH)3、H2SiO3;
(3)在酸性环境下,CrO42-转化为Cr2O72-,即2CrO42-+2H+?Cr2O72-+H2O,应选硫酸酸化,因为氯离子能被氧化,故选C,
故答案为:C;2CrO42-+2H+?Cr2O72-+H2O;
(4)①达到滴定终点时,当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化,
故答案为:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化;
②由Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- 可知,
存在Cr2O72-~6S2O32-,
1 6
n 0.1200mol/L×0.040L
n=0.0008mol
250ml溶液中含有Cr2O72-物质的量为0.0008mol×$\frac{250}{25}$=0.008mol;
所得产品中重铬酸钾纯度=$\frac{0.008mol×294g/mol}{2.500g}$×100%=94.08%,
故答案为:94.08%.
点评 本题以物质的制备流程考查混合物分离提纯的综合应用,为高频考点,涉及流程分析、混合物分离提纯等,把握流程分析及发生的反应为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 CH3COOC2H5+H2O
CH3COOC2H5+H2O ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 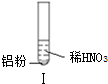 | 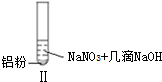 | 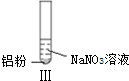 |
| 现象 | 溶液无色,试管上方 呈红棕色 | 产生大量气泡,能使湿润红 色石蕊试纸变蓝 | 产生气泡,能使湿润红色石蕊试纸变蓝 |
| A. | 实验Ⅰ试管上方呈现红棕色的原因是:2NO+O2=2NO2 | |
| B. | 根据实验Ⅱ、Ⅲ的气体检验结果,说明都有NH3产生 | |
| C. | 实验Ⅰ溶液中发生的反应是:Al+6H++3NO3-=Al3++3NO2↑+3H2O | |
| D. | 在实验Ⅰ、Ⅱ、Ⅲ中,NO3-在酸、碱及中性溶液中都被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
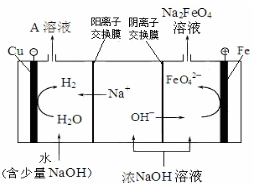
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
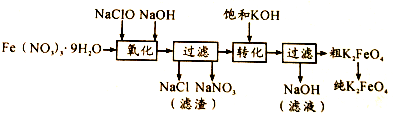
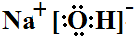 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4Al(SO4)2三种溶液中,c(NH4+由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>cCH3COOH)>c(H+) | |
| C. | 0.1 mol•L-1Na2CO3与0.05mol•L-1 NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 亚硫酸钠 | B. | 溴化铁 | C. | 锌粉 | D. | 铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com