
W、X、Y、Z是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Y元素形成的单质,常温下丙和己均为气体。已知反应:甲+乙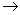 丁+己,甲+丙
丁+己,甲+丙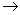 戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
戊+己;常温下0.01 mol·L-1丁溶液的pH为12。下列说法正确的是
A.元素X在周期表中的位置为第2周期ⅥA族
B.元素X、Y、Z的原子半径由大到小的顺序为r(Z)>r(Y)>r(X)
C.1 mol甲与足量的乙完全反应转移的电子数为6.02×1023
D.1.0 L0.1 mol·L-1戊溶液中阴离子的总物质的量小于0.1 mol
科目:高中化学 来源: 题型:
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )

A.4>2>1>3 B.2>1>3>4
C.4>2>3>1 D.3>2>4>1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语使用正确的是( )
A.质子数为6的原子:12C
 B.Al(OH)3的电离方程式:H++AlO
B.Al(OH)3的电离方程式:H++AlO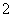 +H2O
+H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
C.CH4Si的结构式:
 |
D.次氯酸的电子式:
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向l00mL该条件下的CaSO4饱和溶液中加入400mL 0.0lmol·L-l的Na2SO4溶液,针对此过程的下列叙述正确的( )
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——选修2化学与技术】
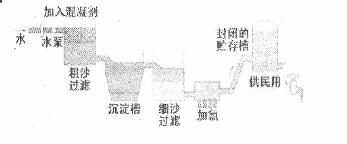 生产自来水的流程图所示。
生产自来水的流程图所示。
(1) FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)实验室过滤操作所用到的玻璃仪器是 。
(3)我们有时感觉自来水“有漂白粉的气味”,是因为使用了氯气消毒,请写出有关化学方程下列物质中, (填写序号)可以作为氯气的代用品。
①臭氧 ②NH3(溶液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱(填“阴”或 “阳”)。
(5)测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH的混合溶液,再加入KI溶液,立即塞好塞子,振荡使其完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.10mol/L Na2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:
2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O
I2+2S2O32-=2I-+S4O62-
水中的溶解氧量为 (以mg·L-l为单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)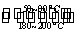 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移, H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+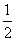 O2(g)==CO(g)
O2(g)==CO(g)  H=-Q1 kJ
H=-Q1 kJ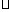 mol-1
mol-1
C(s)+ O2(g)==CO2(g)  H=-Q2 kJ
H=-Q2 kJ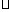 mol-1
mol-1
S(s)+O2(g)==SO2(g)  H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g)  H= 。
H= 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时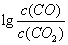 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。

(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 Na2CO3溶液:c(OH-)=c(HCO )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
B.0.1 mol·L-1 NH4Cl溶液:c(NH )=c(Cl-)
)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+) >c(NO )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”独获2011年诺贝尔化学奖。某准晶体W由一定比例的铁、铜、铝组成,取两小块该准晶体:一块投入烧杯①中,注入浓氢氧化钠溶液浸没固体;另一块投入烧杯②中,注入稀硫酸浸没固体。下列分析合理的是
A.烧杯①中,若构成微型电池,负极反应式为2Al-6e-=2Al3+,正极反应式为
6H++6e-=3H2↑
B.烧杯①中,若将电解质溶液换成浓硝酸,构成微型电池时铝为负极,铜为正极,
C.烧杯②中,若铁、铜构成微型电池,则铁为负极;若铝、铁构成微型电池,则铁为正极
D.烧杯②中,固体最终完全溶解,溶液呈蓝色。向溶液中滴加KSCN溶液,溶液不变色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com