
| A�� | �٢� | B�� | �ڢ� | C�� | �ۢ� | D�� | �٢ڢ� |
���� �������ʵ�״̬Ӱ�췴Ӧ�ȵ���ֵ����Ӧ�ȵķ��������ȡ����ȵĹ�ϵ����Ӧ�ȵ���ֵ�뻯ѧ����ʽǰ���ϵ�����������ش�ע��ˮ������ΪҺ̬�Ƿ��ȵģ����ʵķֽⷴӦ�����ȵģ����ʵĻ��Ϸ�Ӧ������Ƿ��ȵģ�
��� �⣺����CH4��g��+2O2��g��=CO2��g��+2H2O��g����ȼ�շ�Ӧ����Ӧ�����ȣ�������0��
CH4��g��+2O2��g��=CO2��g��+2H2O��l����H1��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H2����ˮ����̬���Һ̬���ų����������ԡ�H1����H2���ʴ���
��2H2��g��+O2��g���T2H2O��l����H1��H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H2��������ȼ���Ƿ��ȵģ������ʱ��Ǹ�ֵ��ϵ���ӱ����ʱ���ֵҲ�ӱ������ԡ�H1=2��H2��0�����ԡ�H1����H2������ȷ��
�ۡ�ʱ����һ�������£���1 mol SO2��1 mol O2�ֱ����ں��ݺͺ�ѹ�������ܱ������У���ѹ�ܱ������൱���ں��ݵĻ����������ƶ��ˣ����Ժ�P�£��ﵽƽ��״̬ʱ�ų����������࣬�ﵽƽ��״̬ʱ�ų��������ֱ�ΪQ1��Q2��Q1��Q2������ȷ��
��CaCO3��s���TCaO��s��+CO2��g����H1��0��CaO��s��+H2O��l���TCa��OH��2��s����H2��0�����ԡ�H1����H2���ʴ���
��ѡB��
���� ���⿼�������ʷ�Ӧ�����仯�����жϣ���Ҫ�Ǹ�˹���ɵ�Ӧ�ã���������ͬ��״̬��ͬ�����ﲻͬ����Ӧ�������仯���⣬��Ŀ�ϼ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ƽ�����������ϸ���һ�Ŵ�Сһ����ֽ��Ȼ��NaOH�������ֽ�Ͻ��г��� | |
| B�� | �ѳ�����NaOH�������ʢ����������ˮ���ձ��У��ܽ����������Һת�Ƶ�����ƿ�� | |
| C�� | ������ˮϴ���ձ���������2��3�Σ�ÿ��ϴ�Ӻ����Һ��ע������ƿ�� | |
| D�� | ���Ų�����������ƿ�м�������ˮ��ֱ����Һ��Һ��ǡ����̶����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
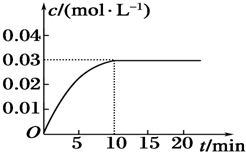
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | X | Y | 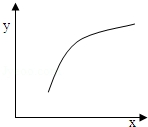 |
| A | �¶� | �����ڻ��������ܶ� | |
| B | A�����ʵ��� | B��ת���� | |
| C | ���������� | C��������� | |
| D | ����Ar�����ʵ��� | �淴Ӧ���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
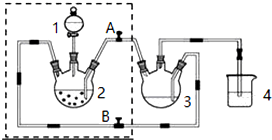
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
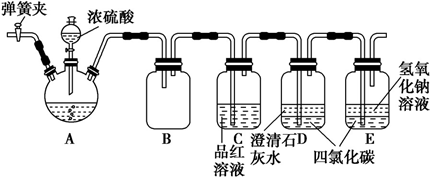
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ����� | �������� | ����״̬ | c��H2SO4��/mol•L-1 | V��H2SO4��/mL | ��Һ�¶�/�� | ������ʧ��ʱ��/s | |
| ��Ӧǰ | ��Ӧ�� | ||||||
| 1 | 0.10 | ˿ | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | ��ĩ | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | ˿ | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | ˿ | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | ��ĩ | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | ˿ | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | ˿ | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | ˿ | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | ˿ | 1.1 | 50 | 30 | 44 | 40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ʵ������������������ֱ���ȫȼ�գ����߷ų������� | |
| B�� | ��H+��aq��+OH-��aq��=H2O��l����H=-57.3kJ•mol-1��֪��������5mol H2SO4��Ũ�����뺬1mol NaOH��ϡ��Һ��ϣ��ų�����������57.3kJ | |
| C�� | ��C��ʯī��=C�����ʯ����H=+1.90kJ•mol-1��֪�����ʯ��ʯī�ȶ� | |
| D�� | ��101kPaʱ��2g H2��ȫȼ������Һ̬ˮ���ų�285.8kJ������������ȼ�յ��Ȼ�ѧ����ʽΪ�� 2H2��g��+O2��g��=2H2O��l����H=-285.8kJ•mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com