
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱 D.产生气泡的速率甲比乙慢
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014河南省周口市高一下学期期末考试化学试卷(解析版) 题型:选择题
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,这些醇和酸重新组合可形成的酯共有40种,在这40种酯中由相同的碳原子的酸与相同碳原子的醇形成的酯有
A.4种 B.8种 C.12种 D.16种
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:实验题
(11分)某化学小组设计实验探究碳酸钠、碳酸氢钠的性质,实验如下:取两支试管分别加入10 mL相同浓度的稀盐酸,将两个各装有0 5 g的Na2CO3和NaHCO3粉末的小气球分别套在两个试管上,将气球内的固体粉末同时倒人试管中,已知盐酸足量,观察实验现象。
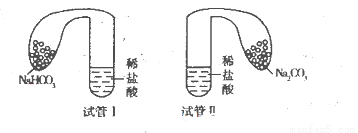
(l)两支试管中均产生气体,其中产生气体较快的为________(填“试管I”或“试管II”),投入________(填化学式)的试管中气球变得比较大。
(2)甲同学触摸上述两试管,发现试管I变冷,试管Ⅱ变热,由此提出不管其状态如何,NaHCO3与HCl反应为吸热反应,Na2CO3与HCl反应为放热反应。
为进一步探究Na2CO3、NaHCO3与盐酸反应的能量变化,乙同学进行下列实验,操作步骤为:①向试剂1中加入试剂2,搅拌、测定温度;②静置、测定温度;③再加入试剂3.搅拌、测定温度、记录。得到以下数据:
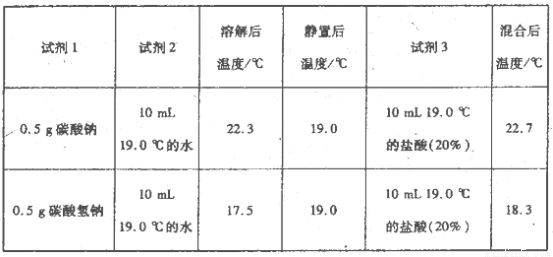
上述实验需要用到的玻璃仪器有________。
乙同学可得出结论:
①NaHCO3的溶解过程________(填“吸热”或“放热”,下同);Na2CO3的溶解过程________。
②CO32-与H+反应为一反应(填“放热”或“吸热”,下同),HCO3-与H+反应为________反应。
(3)比较甲乙同学的实验,你认为 ________(填“甲”或“乙”)的实验方案更合理、更严密。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:选择题
纽约一家公司设计出Soccket足球,每被踢一下,足球的内置机制就会把能量储存起来;被储存的能量可以通过USB接口给手机或其他小家电充电。在Soccket足球充放电的过程中,能量转化的主要形式是

A.电能→ 化学能→电能 B.化学能→电能→化学能
C,机械能→电能→化学能 D.机械能→化学能→电能
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期5月联考化学试卷(解析版) 题型:选择题
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为

下列相关说法不正确的是
A.苹果酸在一定条件下能发生酯化反应
B.苹果酸在一定条件下能发生催化氧化反应
C.l mol苹果酸与足量Na反应生成33. 6 L H2
D.1 mol苹果酸能与含1molNa2CO3 的溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高二期终质量评估化学试卷(解析版) 题型:实验题
(14分)正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小。某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
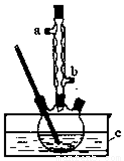
实验过程如下:在容积为100mL的三颈烧瓶中将5mL浓硫酸、14.8g正丁醇和几粒沸石混合均匀,再加热回流一段时间,收集到粗产品,精制得到正丁醚。回答下列问题:
(1)合成粗产品时,液体试剂加入顺序是 。
(2)实验中冷凝水应从 口出去(填“a”或“b”)。
(3)为保证反应温度恒定在135℃,装置C中所盛液体必须具有的物理性质为 。
(4)加热时间过长或温度过高,反应混合液会变黑,写出用NaOH溶液吸收有毒尾气的离子方程式 。
(5)得到的正丁醚粗产品依次用8 mL50%的硫酸、10 mL水萃取洗涤。该步骤中需要的属于硅酸盐材质的实验仪器是烧杯、玻璃棒、 。该仪器使用前需要 。
(6)将分离出的有机层用无水氯化钙干燥,过滤后再进行 (填操作名称)精制得到正丁醚。
(7)本实验最终得到6.50g正丁醚,则正丁醚的产率是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高二期终质量评估化学试卷(解析版) 题型:选择题
提纯下列物质(括号内为少量杂质),所选用的除杂试剂与分离方法正确的是
| 不纯物质 | 除杂试剂 | 分离方法 |
A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
C | 苯(Br2) | KOH溶液 | 分液 |
D | 苯(苯酚) | 浓溴水 | 过滤 |
查看答案和解析>>
科目:高中化学 来源:2013-2014河南师大附中高三4月份月考理综化学试卷(解析版) 题型:填空题
(17分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
物质 浓度 | 0 | 1 | 2 | 3 | 4 |
CH4 | 0.2mol·L—1 | 0.13 mol·L—1 | 0.1 mol·L—1 | 0.1 mol·L—1 | 0.09 mol·L—1 |
H2 | 0 mol·L—1 | 0.2 mol·L—1 | 0.3 mol·L—1 | 0.3 mol·L—1 | 0.33 mol·L—1 |
①3—4min之间,化学平衡向___ ____反应方向移动(填“正”或“逆”)。
②3min时改变的反应条件是____________________(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X1____X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1_______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式_______________________________________
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com