
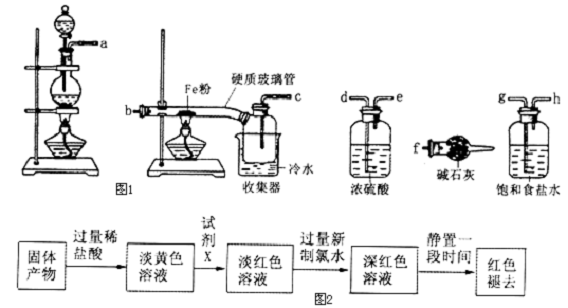
| ||


科目:高中化学 来源: 题型:
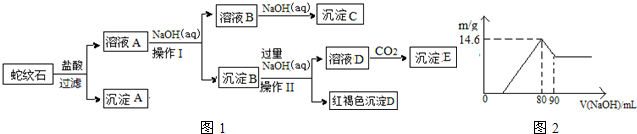
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.9 | 3.3 | 9.4 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组设计研究铜和稀硝酸反应速率[v (NO)]的实验.试回答下列问题:
某兴趣小组设计研究铜和稀硝酸反应速率[v (NO)]的实验.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向2.0mL浓度均为0.lmol/L的KCl、KI混合溶液中滴加l~2滴0.01mol/LAgNO3溶液.振荡,沉淀呈黄色,说明AgCl的溶解度比AgI的溶解度小 |
| B、分别在Na2CO3和NaHCO3两种物质的溶液中,加入少量澄清石灰水,能用来鉴别这两种白色固体 |
| C、向0.1mol/L FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性 |
| D、向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
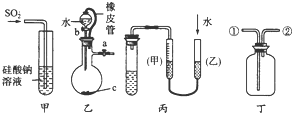
| A、甲装置:可用来证明硫的非金属性比硅强 |
| B、乙装置:橡皮管的作用是能使水顺利流下 |
| C、丙装置:用图示的方法能检查此装置的气密性 |
| D、丁装置:可在瓶中先装入某种液体收集NO气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com