
| A、10:1 | B、1:10 |
| C、1:1 | D、1:2 |
| V酸 |
| V碱 |


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
| A、R一定是共价化合物 |
| B、R一定是离子化合物 |
| C、R可能是共价化合物,也可能是离子化合物 |
| D、R可能是气态物质,也可能是固态物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
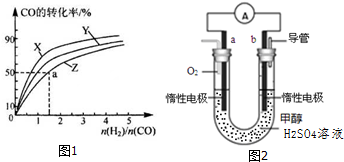
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCl | KBr | AlCl3 | 单质硼 | SiCl4 | |
| 熔点 | 801 | 730 | 190(0.25MPa) | 2300 | -70 |
| 沸点 | 1413 | 1380 | 180 | 2500 | 57 |
| A、SiCl4是分子晶体 |
| B、单质硼是原子晶体 |
| C、AlCl3加热能升华 |
| D、MgCl2所含离子键的强度比NaCl大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,原理如图所示.若负载是镀铜的电镀槽,则左槽溶液由黄色逐渐变为蓝色,下列有关说法正确的是( )
全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,原理如图所示.若负载是镀铜的电镀槽,则左槽溶液由黄色逐渐变为蓝色,下列有关说法正确的是( )| A、外接负载时,左槽作为原电池负极,发生氧化反应 |
| B、外接电源时,左槽连接外接电源的正极,发生还原反应 |
| C、负载是镀铜的电镀槽时,H+由左槽向右槽移动 |
| D、充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com