
【题目】为检验某卤代烃(R﹣X)中的X元素,有下列实验操作:①加热煮沸;②加入AgNO3溶液;③取少量卤代烃;④加入稀硝酸酸化;⑤加入NaOH溶液;⑥冷却.正确操作的先后顺序是( )
A.③①⑤⑥②④
B.③①②⑥④⑤
C.③⑤①⑥④②
D.③⑤①⑥②④
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如下:
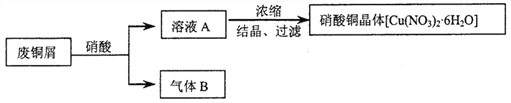
(1)某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比_____________。
②若测得溶液A中H+的浓度为1mol·L-1,则原硝酸的物质的量浓度为________________。(假设反应前后溶液的体积不变)
(2)上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3: Si+3HC1![]() SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)①中制取粗硅的化学方程式:_____________________。
(2)粗硅与HCl 反应完全后,经冷凝得到的SiHCl3 (沸点33.0℃) 中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为______________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
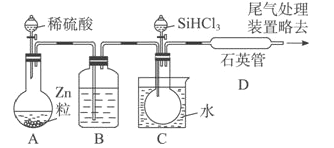
①装置B中的试剂是浓硫酸。装置C 中的烧瓶需要加热,其目的是____________。
②装置D中发生反应的化学方程式为____________。
③为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN 溶液 e.Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与100mL 18.5molL-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲35.84L(标准状况)。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1 mol/L,下列叙述不正确的是( )
A. 反应中共消耗1.8molH2SO4
B. 气体甲中SO2与H2的体积比为7:1
C. 反应中共消耗1.6molZn
D. 反应中共转移3.2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组第Ⅰ栏中的化学反应与第Ⅱ栏中的化学反应,都可以用第Ⅲ栏中的离子方程式表示的是( )
选项 | 第Ⅰ栏 | 第Ⅱ栏 | 第Ⅲ栏 |
A | 向AlCl3溶液中加入少量的NaOH溶液 | 向AlCl3溶液中加入过量的NaOH溶液 | Al3++4OH-===AlO |
B | 往Fe2(SO4)3溶液中滴入氢氧化钠溶液 | 往Fe2(SO4)3溶液中滴入氢氧化钡溶液 | Fe3++3OH-===Fe(OH) 3↓ |
C | 往NaHCO3溶液中滴入少量 Ca(OH)2溶液 | 往Ca(HCO3)2溶液中加入过量NaOH溶液 | Ca2++2OH-+2HCO ===CaCO3↓+CO |
D | 往Na2SiO3溶液中通入过量CO2气体 | 往Na2SiO3溶液中通入少量CO2气体 | SiO32-+CO2+H2O=CO32-+H2SiO3↓ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与硫酸的反应 OH﹣+H+=H2O
B.澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O
C.铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag
D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体化合物、B为金属单质,D、E、M是常见气体单质,其中I为红褐色固体,M为黄绿色,N是胃酸的主要成分,工业上用E和M来制取N,试推断:
(1)写出下列化学式AI
(2)G转化为I的现象为
(3)F+M→H离子方程式为
(4)A+X→C+D的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。

已知:①NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
②二氧化氯极易溶于水。
(1)装置A中NaClO3和Na2SO3制备ClO2气体,其物质的量的理论比值为____________;该装置中采用浓硫酸而不用稀硫酸的原因是___________。
(2)装置B的作用是 _____________;装置C中反应为放热反应,在不改变反应物浓度和体积的条件下,为了使反应在低温下进行,实验中可采取的措施是________________。
(3)写出装置C发生的离子方程式______________。
(4)从装置C反应后的溶液获得干燥的NaClO2晶体的操作步骤为:将装置C中的液体取出在减压和55℃条件下蒸发,至出现大量晶体后,___________________(填实验步骤)。(已知:NaClO2晶体易溶于水,难溶解于乙醇等有机溶剂。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体微溶于水和稀硫酸,不溶于乙醇,但易溶于浓盐酸和氯化铵溶液,发生的反应为:CuCl+Cl-![]() CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
(1)实验室保存新制CuCl晶体的方法是__________。
(2)向硫酸铜溶液中加入亚硫酸铵和氯化铵,会发生反应生成CuCl。
①该反应的离子方程式为_____________。
②(NH4)2SO3要适当过量,目的为保证Cu2+的还原速率、_____________。
③已知Cu2+的沉淀率与NH4Cl、CuSO4的物质的量之比[n(NH4Cl)/n(CuSO4)]的关系如图甲所示,当氯化铵用量增加到一定程度后,Cu2+的沉淀率减小,原因是_______________。

(3)已知:CuCl固体、CuOH固体分别为白色和橙黄色,且Ksp(CuCl)=1.2×10-6,Ksp(CuOH)=1.2×10-14。用铜电极电解饱和食盐水的装置如图乙所示,阳极的电极反应式为Cu-e-+Cl-=CuCl。则实验过程中的实验现象为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com