
| A. | 100℃纯水的pH=6,说明加热可导致水呈酸性 | |
| B. | pH=4的醋酸溶液,稀释至10倍后pH=5 | |
| C. | 0.2mol/L的盐酸,与等体积水混合后pH=1 | |
| D. | 25℃时,pH=3的醋酸溶液.与pH=11的NaOH溶液等体积混合后pH=7 |
分析 A、溶液的酸碱性取决于溶液中氢离子和氢氧根离子的浓度大小;
B.根据醋酸是弱电解质,稀释后醋酸的电离程度增大,溶液中氢离子的物质的量增大;
C.盐酸是强酸完全电离,0.2mol/L的盐酸溶液中氢离子浓度为0.2mol/L,加入等体积的水,氢离子浓度减少一半;
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,醋酸溶液中电离平衡正向进行,得到醋酸和醋酸钠的混合溶液,以醋酸的电离为主,溶液呈酸性.
解答 解:A、温度升高,水的电离程度增大,所以100℃纯水的pH=6,但是纯水中氢离子与氢氧根离子浓度相等,溶液显示中性,故A错误;
B.pH=4的醋酸溶液,存在电离平衡,溶液中氢离子浓度为0.0001mol/L,稀释后醋酸的电离程度增大,平衡正向进行溶液中氢离子的物质的量增加,当稀释至10倍后溶液中氢离子浓度大于0.00001mol/L,溶液的pH小于5,故B错误;
C.HCl完全电离,0.2mol/L的盐酸溶液中氢离子浓度为0.2mol/L,与等体积水混合后氢离子浓度为0.1mol/L,pH=1,故C正确;
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,氢氧化钠溶液中氢氧根离子和醋酸溶液平衡状态下氢离子恰好反应,醋酸又电离出氢离子,所以反应后是得到醋酸和醋酸钠的混合溶液,以醋酸的电离为主,溶液呈酸性,故D错误;
故选C.
点评 本题考查了弱电解质在溶液中的电离平衡,题目难度中等,注意溶液的酸碱性取决于溶液中氢离子和氢氧根离子的浓度大小,明确溶液的pH与溶液酸碱性的关系和计算,本题旨在巩固基础,培养学生分析、理解能力.


科目:高中化学 来源: 题型:选择题
| A. | 化学键主要包括离子键、共价键和氢键等 | |
| B. | 离子键是阴、阳离子通过静电作用而形成的化学键 | |
| C. | 任何离子键在形成过程中必定有电子的得与失 | |
| D. | 非金属元素的原子之间不可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{HCI(aq)}{→}$SiCl4 | |
| B. | 饱和食盐水$\stackrel{NH_{3}•CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Na$\stackrel{O_{2}/△}{→}$Na2O2$\stackrel{HI(aq)}{→}$NaI | |
| D. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示反应的速率,其比值是3:2:1 | |
| C. | 在2 min末时的反应速率,用反应物B来表示是0.3 mol•L-1•min-1 | |
| D. | 在这2 min内用B和C表示的反应速率的值都是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工厂采用增大压强以提高原料的转化率 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶有气泡从溶液中冒出 | |
| D. | 2NO2(g)═N2O4(g)的平衡体系中,加压缩小体积后颜色加深用来表示可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
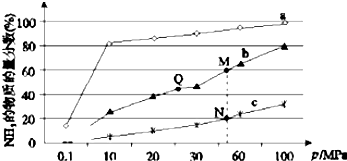
| A. | 上图中M、N、Q点平衡常数K 的大小关系为K(M)=K(Q)>K(N) | |
| B. | 加催化剂能加快反应速率但H2的平衡转化率不变 | |
| C. | 相同压强条件下,投料相同,达到平衡所需时间关系为a>b>c | |
| D. | 由曲线a可知,当压强增加到10OMPa以上,NH3的物质的量分数可达到100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
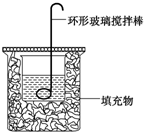 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com