
| A. | 奥运火炬燃烧主要是将化学能转变为热能和光能 | |
| B. | 丙烷常温下是液体 | |
| C. | 丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极 | |
| D. | 丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ/mol |
分析 A.燃料燃烧过程中放出热量且同时产生光;
B.碳原子个数小于等于4的烷烃常温下都是气态;
C.燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极;
D.水蒸气不是氢元素的稳定氧化物.
解答 解:A.燃料燃烧过程中放出热量且同时产生光,所以奥运火炬燃烧主要是将化学能转变为热能和光能,故A正确;
B.碳原子个数小于等于4的烷烃常温下都是气态,丙烷分子中含有3个C原子,所以常温下丙烷是气体,故B错误;
C.燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,则丙烷、空气和铂片构成的原电池中,通入丙烷的电极是负极,故C错误;
D.水蒸气不是氢元素的稳定氧化物,丙烷的燃烧热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ/mol,故D错误;
故选A.
点评 本题考查化学电源新型电池、热化学方程式等知识点,为高频考点,明确原电池原理、热化学方程式书写方法是解本题关键,注意燃烧热概念中关键词,题目难度不大.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题
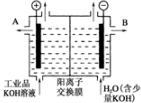
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
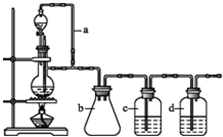 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
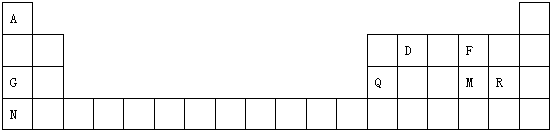
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
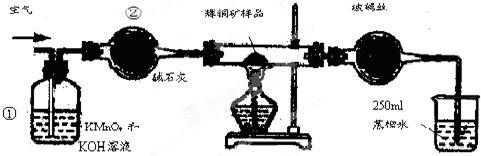
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1Na2S溶液中含有0.2NA个Na+ | |
| B. | 标准状况下,22.4L的H2O含有2NA个氢原子 | |
| C. | 常温下,44gCO2含有NA个氧原子 | |
| D. | 0.1molNa与足量O2反应生成Na2O,转移0.1NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
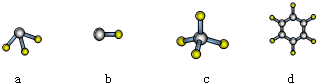
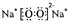 ,该物质含有的化学键的类型是离子键、非极性共价键 .
,该物质含有的化学键的类型是离子键、非极性共价键 .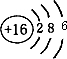 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质中一定存在共价键 | |
| C. | 共价化合物中一定存在共价键 | |
| D. | 离子化合物中只含有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com