
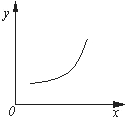
 汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
汽车尾气净化中的反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.该反应在恒容的密闭容器中达到平衡后,若仅改变下图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )| 选项 | x | y |
| A | 压强 | 气体的平均相对分子质量 |
| B | 温度 | 平衡常数K |
| C | NO的浓度 | NO的转化率 |
| D | 温度 | 容器内混合气体的密度 |
| A. | A | B. | B | C. | C | D. | D |
分析 2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1反应是气体体积减小的放热反应,分析图象随x增大y增大,结合化学平衡移动原理分析选项.
解答 解:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1反应是气体体积减小的放热反应;
A、若x为压强,随压强增大,平衡正向移动,总质量不变,总物质的量减小,则气体的平均相对分子质量随之增大,图象变化趋势符合,故A正确;
B、若x为温度,随温度升高平衡逆向进行,则平衡常数K减小,图象变化趋势错误,故B错误;
C、若x为NO的浓度,随NO的浓度增大,平衡正向进行,但NO的转化率减小,图象变化趋势错误,故C错误;
D、若x为温度,随温度升高平衡逆向进行,气体质量不变,体积不变,密度不变,图象曲线变化趋势错误,故D错误;
故选A.
点评 本题考查了化学平衡影响因素分析判断,注意平衡常数随温度变化,题目难度中等.


科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:
X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,反应类型是加聚反应.
,反应类型是加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )
5、常温下,反应CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量变化如图所示.反应达到平衡后,要使该反应化学平衡向右移动,其他条件不变,可采取的措施是( )| A. | 升高温度 | B. | 分离出甲醇 | ||
| C. | 缩小反应器体积 | D. | 使用合适的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2[Co(NCS)3]Cl | B. | Na2[SiF2Cl2Br2] | C. | Na3[AlF6] | D. | [Cr(NH3)4(H2O)2]Cl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20 mol/L Ag+ | B. | 0.20 mol/L Al3+ | C. | 0.20 mol/L Cu2+ | D. | 0.20 mol/L Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com