
| 正极 | 负极 | 电解质溶液 | |
| A | C | Zn | ZnSO4 |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuCl2 |
| D | Cu | Zn | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 由电池反应式Zn+Cu2+═Zn2++Cu知,锌失电子发生氧化反应,作负极;不如锌活泼的金属或导电的非金属作正极,正极上铜离子得电子发生还原反应,电解质溶液中应含有铜离子,所以应为铜盐.
解答 解:由电池反应式Zn+Cu2+═Zn2++Cu知,锌失电子发生氧化反应,失电子的物质的负极上发生氧化反应,所以锌作负极;
不如锌活泼的金属或导电的非金属作正极,可用铜作正极;
正极上铜离子得电子发生还原反应,所以电解质溶液中应含有铜离子,可用含有铜离子的盐溶液作电解质溶液,AD中负极不能和电解质溶液发生氧化还原反应,
故选C.
点评 本题考查了原电池原理,难度不大,注意根据方程式中发生的反应类型判断原电池的正负极.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
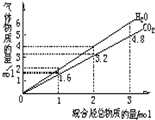 两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量变化如图所示,则下列对混合烃的判断正确的是( )| A. | 一定含有甲烷 | B. | 一定含有乙烯 | C. | 一定含有丙炔 | D. | 一定不含乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.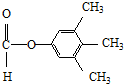 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 +6 | +3 | +1 | +1 |
| A. | 氢化物稳定性的强弱:b>d | |
| B. | 元素e的氧化物只能与酸反应 | |
| C. | 金属性的强弱:f<g | |
| D. | 元素a与元素d形成的化合物属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期第ⅡA族 | B. | 第三周期第ⅢA 族 | C. | 第三周期第ⅡA 族 | D. | 第二周期第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 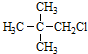 | B. | 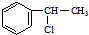 | C. | CH3Cl | D. | 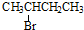 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com