
(4分) 合成氨工业对国民经济和社会发展具有重要的意义。向2L密闭容器中通入2mol 气体N2
和6mol气体H2,在一定条件下发生反应:N2(g)+3H2(g) 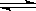 2NH3(g);已知:反应2min达到平衡 ,此时N2的浓度减少了2/3。
2NH3(g);已知:反应2min达到平衡 ,此时N2的浓度减少了2/3。
回答下列问题:
⑴反应2min内,用NH3表示该反应的速率是________________;
⑵反应平衡时,N2的转化率为 ;
⑶如果只升高反应温度,其他反应条件不变,平衡时NH3浓度为 1.1 mol/L,则该反应的ΔH 0;(填“>”、“<”或“=”)
⑷合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
①20 MPa~50 MPa ②500℃的高温 ③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
⑸如果其他条件不变,将容器的容积变为 1L,进行同样的实验,则与上述反应比较:
反应速率 (填“增大”、“减小”或“不变”),理由是 ;
科目:高中化学 来源: 题型:
(4分) 合成氨工业对国民经济和社会发展具有重要的意义。向2L密闭容器中通入2mol 气体N2和6mol气体H2,在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g);已知:反应2min达到平衡 ,此时N2的浓度减少了2/3。
回答下列问题:
⑴反应2min内,用NH3表示该反应的速率是________________;
⑵反应平衡时,N2的转化率为 ;
⑶如果只升高反应温度,其他反应条件不变,平衡时NH3浓度为 1.1 mol/L,则该反应的ΔH 0;(填“>”、“<”或“=”)
⑷合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
①20 MPa~50MPa ②500℃的高温 ③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
⑸如果其他条件不变,将容器的容积变为 1L,进行同样的实验,则与上述反应比较:
反应速率 (填“增大”、“减小”或“不变”),理由是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号) 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1molN2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;
B中NH3的体积分数为b,放出热量Q2kJ。则:a_____b(填>、=、<), Q1_____Q2(填>、=、<), Q1_____92.4(填>、=、<)。
查看答案和解析>>
科目:高中化学 来源:2010年贵州册亨民族中学高二上学期期末考试化学卷(理) 题型:填空题
(4分) 合成氨工业对国民经济和社会发展具有重要的意义。向2L密闭容器中通入2mol 气体N2和6mol气体H2,在一定条件下发生反应:N2(g)+3H2(g)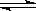 2NH3(g);已知:反应2min达到平衡,此时N2的浓度减少了2/3。
2NH3(g);已知:反应2min达到平衡,此时N2的浓度减少了2/3。
回答下列问题:
⑴反应2min内,用NH3表示该反应的速率是________________;
⑵反应平衡时,N2的转化率为 ;
⑶如果只升高反应温度,其他反应条件不变,平衡时NH3浓度为 1.1mol/L,则该反应的ΔH 0;(填“>”、“<”或“=”)
⑷合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
①20 MPa~50 MPa ②500℃的高温 ③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
⑸如果其他条件不变,将容器的容积变为 1L,进行同样的实验,则与上述反应比较:
反应速率 (填“增大”、“减小”或“不变”),理由是 ;
查看答案和解析>>
科目:高中化学 来源:2010年北京五中高二下学期期末考试化学试题 题型:填空题
(12分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号) 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
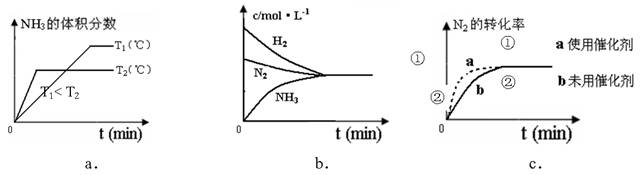
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;
B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com