

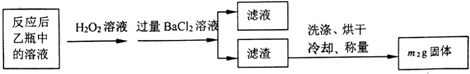
| 试验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KmnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
分析 (1)通入空气时,空气中的二氧化碳会对实验产生干扰;通空气为反应提供氧气,还可以把生成的二氧化硫全部排入乙中;
(2)过氧化氢具有强氧化性,将亚硫酸钠氧化为硫酸钠,同时生成水;
(3)最终得到的沉淀为硫酸钡,根据硫原子守恒计算硫铁矿中硫的质量,从而计算其质量分数;
(4)用Fe粉作还原剂,增大了溶液中亚铁离子的物质的量;
(5)配制250ml一定物质的量浓度的溶液需要烧杯、玻璃棒、胶头滴管、量筒、250ml容量瓶等仪器;
(6)高锰酸钾具有酸性和强氧化性;最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色,说明滴定到达终点;
(7)根据关系式MnO4-~5Fe2+计算亚铁离子的浓度.
解答 解:(1)通入空气时,空气中的二氧化碳会对实验产生干扰,所以要用氢氧化钠溶液除去空气中的二氧化碳,使装置乙中的溶液只吸收黄铁矿煅烧产生的二氧化硫;通空气为反应提供氧气,还可以把生成的二氧化硫全部排入乙中,使反应生成的二氧化硫被乙中溶液完全吸收;
故答案为:除去空气中的二氧化碳,使装置乙中的溶液只吸收黄铁矿煅烧产生的二氧化硫;提供反应物氧气,排除装置中生成的二氧化硫,使二氧化硫完全被乙吸收;
(2)过氧化氢具有强氧化性,将亚硫酸根离子氧化为硫酸根,同时生成水,反应方程式为:Na2SO3+H2O2=Na2SO4+H2O,
故答案为:Na2SO3+H2O2=Na2SO4+H2O;
(3)根据硫元素守恒,m1gFeS2中的硫元素最终全部生成BaSO4,则有n(BaSO4)=$\frac{{m}_{2}}{233}$mol,所以n(S)=$\frac{{m}_{2}}{233}$mol,所以黄铁矿中硫元素的质量分数为:$\frac{\frac{{m}_{2}}{233}mol×32g/mol}{{m}_{1}}$×100%=$\frac{32{m}_{2}}{233{m}_{1}}$×100%,
故答案为:$\frac{32{m}_{2}}{233{m}_{1}}$×100%;
(4)用Fe粉作还原剂,Fe与Fe3+生成Fe2+,增大了溶液中亚铁离子的物质的量,则所测得的铁元素的含量偏大,故答案为:偏大;
(5)Ⅲ的步骤③中,一定物质的量浓度溶液的配制中,除了烧杯、玻璃棒、胶头滴管外,还需要250mL容量瓶,故答案为:250mL容量瓶;
(6)高锰酸钾具有酸性和强氧化性,能够腐蚀碱式滴定管中的橡胶管,所以用酸式滴定管盛放;最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色,说明滴定到达终点,
故答案为:酸式;最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色;
(7)第三次实验误差较大,舍去,其余三次实验消耗的高锰酸钾溶液的平均体积为25.00mL,
MnO4-~~~~~~~5Fe2+
1mol 5mol
0.1mol/L×25.00×10-3L c(Fe2+)×25.00×10-3L
解得c(Fe2+)=0.500mol/L,
故答案为:0.500mol/L.
点评 本题考查物质成分和含量的测定,涉及化学方程式的书写、溶液的配制、氧化还原滴定、化学计算等,具有较强的综合性,计算时注意从质量守恒与关系式的角度分析.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
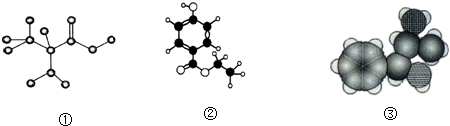
| A. | 图①是球棍模型,其化学式为:C3H7O2N,是一种蛋白质 | |
| B. | 图②是比例模型,其化学式为:C9H13NO,该物质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| C. | 图③是球棍模型,其化学式为:C9H10O3,1 mol该物质能消耗3mol氢氧化钠 | |
| D. | 图③是比例模型,其化学式为:C9H13ON,能够发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②③⑤ | C. | ①③⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
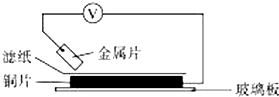 将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )
将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | +0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
| A. | 在四种金属中C的还原性最弱 | |
| B. | 金属B能从硫酸铜溶液中置换出铜 | |
| C. | AD若形成原电池时A为正极 | |
| D. | AB形成合金时,将该合金露置在空气中,A先被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 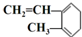 与Br2发生1:1加成反应的产物有5种 与Br2发生1:1加成反应的产物有5种 | |
| B. | 咖啡鞣酸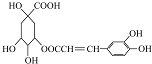 在酸性条件下水解,产物均为手性分子 在酸性条件下水解,产物均为手性分子 | |
| C. | 乙醛和丙烯醛(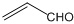 )不是同系物,但它们与H2充分反应后的产物是同系物 )不是同系物,但它们与H2充分反应后的产物是同系物 | |
| D. | 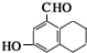 分子中所有原子不可能在同一平面上 分子中所有原子不可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
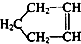 可简写为
可简写为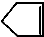 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: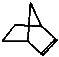
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第4周期第VA族 | B. | 第5周期第IIIA族 | C. | 第5周期第Ⅳ族 | D. | 第4周期第IIIA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com