
分析 (1)铝氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)过氧化钠与水反应生成氢氧化钠和氧气;
(3)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
(4)碳酸氢钠的溶解度小于碳酸钠,反应中会析出碳酸氢钠;
(5)氢氧化钙少量,反应生成碳酸钙沉淀、碳酸钠和水.
解答 解:(1)金属铝与氢氧化钠溶液反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)过氧化钠与水的反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(3)根据氢氧化铝显两性,可以与强酸反应也可以与强碱反应,氢氧化铝和氢氧化钠反应得到到偏铝酸钠和水:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)将二氧化碳气体通入饱和的碳酸钠溶液中,反应生成碳酸氢钠,离子反应为:CO2+H2O+2Na++CO32-=2NaHCO3↓,
故答案为:CO2+H2O+2Na++CO32-=2NaHCO3↓;
(5)氢氧化钙少量,二者反应生成碳酸钙、碳酸钠和水,离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O,
故答案为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O.
点评 本题考查了离子方程式的书写,为高考的高频题,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握常见的难溶物、弱电解质,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
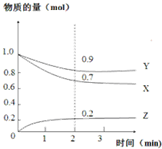 某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是( )
某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是( )| A. | 该反应的化学方程式:3X+Y?2Z | |
| B. | 反应开始至2min,Z的平均反应速率:0.1mol/(L•min) | |
| C. | 若在3min后,把Z从反应体系中分离,平衡不移动 | |
| D. | 用X表示该化学反应速率比用Y表示的要快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32ˉ+CO2+H2O═H2SiO3↓+CO32ˉ | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2ˉ+4NH4++2H2O | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32ˉ+2H+═SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过氧化钠与水的反应中.固体每增重mg,转移电子为0.2NA | |
| B. | 在准状况下,2.24LCl2与过量NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2molN2转移的电子数为6NA | |
| D. | 标准状况下,22.4LCCl4中含有的碳原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
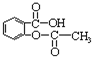 b.烯烃
b.烯烃 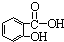 c.炔烃
c.炔烃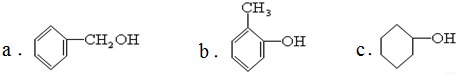
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始时,产生氢气的速率相同 | |
| B. | 参加反应的金属的物质的量比为1:1:1 | |
| C. | 所得溶液的质量相等 | |
| D. | 参加反应的金属的质量比为12:9:28 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com