
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
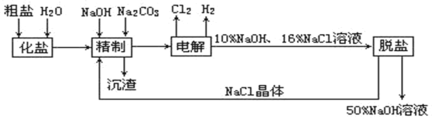
依据上图,完成下列填空:
(1)用惰性电极电解饱和食盐水时,与电源正极相连的电极上所发生的电极反应式为_____________;与电源负极相连的电极附近,溶液pH______(选填:不变、升高或下降)。
(2)如果粗盐中SO42-含量较高,必须加钡剂除去,该钡试剂可以是_________;
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_______________、_______________;
(4)氯碱工业所用的隔膜电解装置,广泛应用于多种化工产品生产,如工业上用惰性电极电解Na2CO3溶液得到含NaHCO3,原理如下图所示。
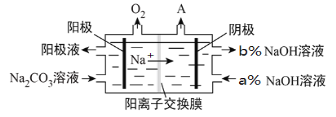
阴极产生的物质A的化学式为__________,a%_____b%(填“<、>、=”),NaHCO3产生在_______室(填“阴极”或“阳极”)。
【答案】2Cl--2e-=Cl2 ↑ 升高 ac Mg2++2OH-=Mg(OH)2↓ Ca2++CO32- =CaCO3↓ H2 < 阳极
【解析】
(1)电解食盐水,与电源正极相连的电极为阳极,生成氯气,与电源负极相连的电极为阴极,生成氢气和NaOH;
(2)添加钡试剂除去SO42-,注意不能引入新的杂质;
(3)精制过程就是将杂质离子转化为沉淀除去的过程,Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(4)用惰性电极电解Na2CO3溶液得到含NaHCO3,阴极上氢离子得到电子生成氢气,剩余氢氧根生成氢氧化钠;阳极反应为2H2O-4e-═O2↑+4H+,溶液中c(H+)增大,发生反应:CO32-+H+═HCO3-,据此分析解答。
(1)电解食盐水,与电源正极相连的电极为阳极,阳极上生成氯气,电极反应式为2Cl--2e-═Cl2↑,与电源负极相连的电极为阴极,阴极上生成氢气和NaOH,生成了碱,所以阴极附近溶液的pH升高,故答案为:2Cl--2e-═Cl2↑;升高;
(2)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以选ac,故答案为:ac;
(3)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀,精制过程发生反应的离子方程式为:Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓,故答案为:Ca2++CO32-=CaCO3↓;Mg2++OH-=Mg (OH)2↓;
(4)阴极上氢离子得到电子生成氢气,则阴极产生的物质A的化学式为H2,剩余氢氧根生成氢氧化钠,使得排出的氢氧化钠浓度增大,即a%<b%,阳极反应为2H2O-4e-═O2↑+4H+,溶液中c(H+)增大,发生反应:CO32-+H+═HCO3-,部分Na+透过离子交换膜向阴极移动,最终获得含NaHCO3的阳极液,故答案为:H2;<;阳极。


科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是( )
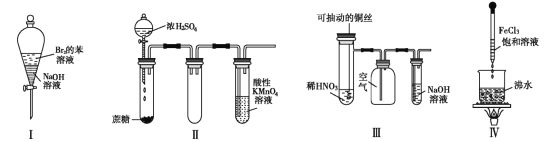
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )

A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,![]() 不断增大
不断增大
D. 当n(NaOH)=0.05mo1时,溶液中有:c(Cl-)> c(NH4+)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择完成下列实验的装置。

(1)分离水和植物油,选用____________(填序号,下同)。
(2)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用____________。
(3)加热NH4Cl和Ca(OH)2固体混合物制取NH3,用____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的结构简式 看,苯分子中含有碳碳双键,应属于烯烃
看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是淀粉水解的最终产物;Y俗名酒精;Z是一种植物生长调节剂,可以把果实催熟,在催化剂作用下,Z可以制得重要的包装材料P。
请回答下列问题:
(1)X的分子式为___。
(2)Y与Na反应的化学方程式为___。
(3)Z→P反应的化学方程式为___,属___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硒形成的单质及其化合物有重要的科学研究价值,请回答下列问题:
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。基态氮原子的价电子轨道表示式为______________;其核外电子共占据____个能级;邻氨基吡啶的铜配合物中Cu2+的配位数是_______。

(2)高聚氮晶体结构如图所示,每个氮原子与另外三个氮原子结合形成空间网状结构。固态高聚氮是_______晶体;该晶体中n(N)与n(N—N)之比为_______;这种高聚氮N—N键的键能为160 kJ·mol-1,而N2的键能为942 kJ·mol-1,其可能潜在的应用是__________。

(3)NO3-的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因__________。
(4)硒有三种晶体(α单斜体、β单斜体和灰色三角晶),灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如图所示:

已知正六棱柱的边长为acm,高为bcm,阿伏加德罗常数的值为NA,则该晶体的密度为_____g·cm-3(用含NA、a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,M=240g·mol—1。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
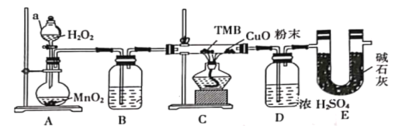
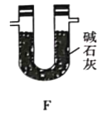
(1) 写出A中的化学反应方程式:__________________;
(2) B 中试剂是___________,作用是________________ ;
(3) 装置C中CuO粉末的作用为________________。
(4) 理想状态下,将4.80 gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60 g,E增加14.08 g,则TMB的分子式为____________。
(5)有同学认为,用该实验装置测得的TMB分子式不准确,应在干燥管E后再添加一个装有碱石灰的干燥管F。你认为是否需要添加F装置__________(填“需要”或“不需要”),简述理由________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com