
某学生对SO2与漂粉精的反应进行实验探究:
| 操 作 | 现 象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是____________________________________
________________________________________________________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是________。
(3)向水中持续通入SO2,未观察到白雾。推测现象ⅰ的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是________。
②由实验a、b不能判断白雾中含有HCl,理由是________________________________
________________________________________________________________________。
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X。
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象ⅲ中黄绿色褪去的原因:____________________________
________________________________________________________________________。
答案 (1)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(2)碱性、漂白性
(3)①检验白雾中是否含有Cl2,排除Cl2干扰
②白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀
(4)向漂粉精溶液中逐滴加入稀硫酸,观察溶液是否变为黄绿色
(5)①CaSO4
②SO2+Cl2+2H2O===SO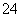 +2Cl-+4H+
+2Cl-+4H+
解析 (1)联系氯的化合物基础知识和生产漂粉精的原理,其化学方程式:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。
(2)pH试纸先变蓝,说明漂粉精溶液呈碱性,后褪色是由于ClO-的强氧化性所致。
(3)检验白雾中有无HCl的关键是检验出Cl-的存在,故实验a、b即围绕Cl-的检验展开。实验a的目的是通过湿润碘化钾淀粉试纸是否变蓝判断有无Cl2的干扰。实验b试图通过AgCl的生成来检验Cl-的存在,但应考虑到过量SO2和AgNO3溶液反应生成白色沉淀。
(4)题干具有明显的提示性,出现黄绿色的原因是随着酸性的增强而产生Cl2。故应设计使用无还原性的稀硫酸来确认其可能性。
(5)①A瓶中所得沉淀的成分可能是CaSO3、CaSO4或二者的混合物,加入稀HCl,无明显变化,排除CaSO3,故X为CaSO4,因CaSO4微溶于水,再取上层清液加入BaCl2溶液时,产生BaSO4沉淀,进一步证明X为CaSO4。
②溶液呈黄绿色是因Cl2溶于水而产生的现象,随着SO2的持续通入,两者发生反应生成无色物质盐酸和硫酸,化学方程式为SO2+Cl2+2H2O===2HCl+H2SO4,离子方程式为SO2+Cl2+2H2O===4H++SO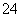 +2Cl-。
+2Cl-。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
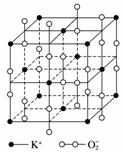
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O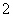
B.晶体中每个K+周围有8个O ,每个O
,每个O 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.淀粉、油脂、氨基酸都能水解,但水解产物不同
B.做衣服的棉和麻与淀粉互为同分异构体
C.植物油和裂化汽油都能使溴水褪色
D.对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
有6.85 g铅的氧化物,用足量的CO在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到4.00 g 固体沉淀物,这种铅的氧化物的化学式为( )
A.PbO
B.PbO2
C.Pb3O4
D.Pb3O4和PbO2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
4.6 g铜镁合金完全溶解于100 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到4 480 mL NO2和336 mL N2O4的混合气体(标准状况),向反应的溶液中加入1.0 mol·L-1 NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是69∶46
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.产生沉淀8.51 g
D.离子恰好完全沉淀时,加入NaOH溶液的体积是230 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
已知亚硫酸钠在空气中能被氧气氧化生成硫酸盐。
Ⅰ.甲同学设计两种方案来检验Na2SO3溶液是否发生变质。
方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠溶液没有变质。
方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠溶液完全变质。
请你对两方案作出评价:
方案一:________(填“合理”或“不合理”),理由是_______________________
________________________________________________________________________。
方案二:________(填“合理”或“不合理”),理由是____________________________
________________________________________________________________________。
Ⅱ.乙同学探究Na2SO3溶液是否发生变质,设计如下实验测定1.0 mol·L-1 Na2SO3溶液的实际浓度。
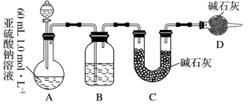
(1)分液漏斗中应加入足量的下列哪种试剂?________(填字母)
a.浓硝酸 b.65%硫酸 c.浓盐酸
(2)实验前后测得C装置增重3.2 g,则Na2SO3溶液实际的物质的量浓度为________。
(3)该实验装置还存在一个明显的缺陷是________。
答案 Ⅰ.不合理 亚硫酸钠部分变质时滴加盐酸也会产生气泡 不合理 亚硫酸钠也能与氯化钡反应生成白色沉淀,亚硫酸钠未变质或部分变质时也会产生白色沉淀
Ⅱ.(1)b (2)0.83 mol·L-1
(3)缺少一个驱赶残留二氧化硫气体的装置(或其他合理答案)
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性介质(如KOH)
负极:________________________________________________________________________;
正极:________________________________________________________________________;
总反应式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度来看,不恰当的一种物质是________。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式________________________________________________________________________
________________________________________________________________________。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是________。
A.Ag B.Cu
C.Al D.Fe
(4)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①________;②Na2CO3;③________;④NaHCO3。
将得到的固体重新溶解于水,在溶液中加盐酸,使溶液的pH=7,再将溶液蒸干,得到固体的质量是________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com